
氟维司群成为单药内分泌治疗优选药物,丰富ER+/HER2-晚期乳腺癌一线治疗决策。
2023年2月14日,由中国医学科学院肿瘤医院徐兵河院士牵头在中国20余家中心开展的FRIEND研究成果正式发表于《欧洲癌症杂志》,在这项II期随机对照临床研究中[1],氟维司群一线治疗相比依西美坦显著改善ER+/HER2-晚期乳腺癌患者的中位无进展生存期(PFS,8.5个月vs 5.6个月,P=0.014)。研究结果进一步验证了氟维司群单药作为post-AI内分泌治疗优选方案的地位,并且也为晚期一线不适合接受CDK4/6抑制剂治疗的ER+/HER2-乳腺癌患者提供了新的选择。基于此背景,医学界肿瘤频道特邀王佳玉教授深入解读FRIEND研究成果,并分享该研究带给临床实践的思考与启示。
研究背景
内分泌治疗是ER+/HER2-乳腺癌不可缺少的全身治疗方法,氟维司群有别于他莫昔芬及AI类药物,是具有新颖作用机制的新型ER拮抗剂[2]。研究设计之初的2015年前后,在氟维司群的系列研究探索中,II期FIRST研究[3]和III期FALCON研究[4]先后验证了氟维司群相比AI在HR+/HER2-晚期乳腺癌患者中的一线治疗获益,并由此初步奠定了当时氟维司群最强内分泌单药治疗的地位。
但由于大多数ER+/HER2-晚期乳腺癌在疾病早期就已接受过AI治疗,而既往对于post-AI患者的治疗选择如何(换用氟维司群还是另一种AI),临床上仍存在争议。FRIEND研究在中国绝经后post-AI的HR+/HER2-晚期乳腺癌患者中,探索氟维司群相比依西美坦一线治疗的疗效和安全性,为临床上post-AI的内分泌治疗选择给出答案。
研究方法
FRIEND研究是一项多中心、前瞻性、随机、开放性、平行对照、Ⅱ期临床试验,共纳入145例既往接受过≥2年辅助NSAI治疗的绝经后ER+/HER2-晚期乳腺癌患者,按照1:1随机分组,分别接受氟维司群(n=77例,500mg,第0、14和28天给药,随后每28±3天肌注)和依西美坦(n=67例,25mg,QD)一线单药治疗。
研究主要终点为PFS,次要终点包括客观缓解率(ORR)、至治疗失败时间(TTF)、缓解持续时间(DOR)、总生存期(OS),探索性终点包括基因突变相关结局和安全性。
研究结果
■ 患者
本研究于2016年1月1日开展,直至2021年6月5日对患者进行最终随访(约5.5年),在入选的145例患者中,144例患者的数据用于全分析集(FAS)评价,139例用于安全性集(SS)分析,其中依西美坦组64例,氟维司群组75例。5例患者因不符合入选标准而退出研究。共有117例患者的数据用于符合方案集(PPS)分析,129例患者接受基因检测分析。
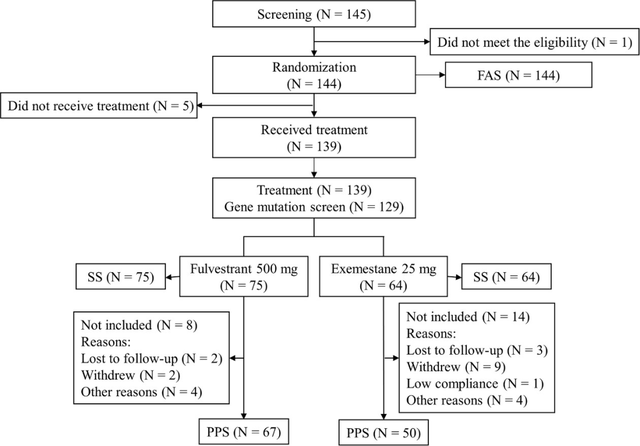
图1.研究流程图(FAS=全分析集;SS=安全性集;PPS=符合方案集)
两组患者的人口统计学基线值(p>0.05)或ECOG体能状态评分(p>0.05)之间无差异。转移部位主要包括骨、淋巴结、胸壁、胸膜、肺和肝脏,两组的转移情况相似。ER和PR双阳性率在依西美坦组为84.9%,而氟维司群组为85.5%。两组的无治疗间期(TFI,辅助内分泌治疗结束直至开始氟维司群或依西美坦治疗)相当。
■ 主要终点
氟维司群组的中位PFS为8.5个月,显著优于依西美坦组的5.6个月(p=0.014,HR=0.62,95%CI:0.42-0.91),疾病进展和死亡风险降低38%(图2)。
 图2.全分析集(FAS)人群中的PFS
图2.全分析集(FAS)人群中的PFS
■ 缓解情况
在接受治疗的139例患者中,22例无效(依西美坦组14例,氟维司群组8例),针对139例患者中117例进行肿瘤评价,共19例患者疾病缓解,氟维司群组的ORR为19.5%,显著优于他莫昔芬组的6.0%(p=0.017),其中两组的完全缓解(CR)率分别为2.6%和0%。另外,氟维司群组的疾病控制率(DCR,67.5%和53.7%,p=0.09)和中位DOR(13.1个月和6.0个月,p=0.065),以及中位TTF(8.4个月和5.5个月,p=0.008)也在数值上优于他莫昔芬组(表1)。
表1.全分析集(FAS)人群的疾病缓解情况(ICR评估)

■ 探索性分析结果
129例接受基因分析患者中最常见的突变见于ESR1(18/14.0%)、PIK3CA(40/31.0%)和TP53(29/22.5%)基因。并且,在ESR1-野生型患者中,氟维司群组较依西美坦组患者的PFS显著更长(8.5个月vs 5.8个月;P=0.035);尽管在ESR1突变人群中也存在相似的趋势,但无统计学显著性。此外,氟维司群组所有c-MYC和BRCA2突变患者的PFS时间均显著长于依西美坦组(P=0.049;P=0.039)。
■ 安全性
在67例患者中,共检测到237例AE,其中依西美坦组27例患者发生104例AE(42.2%),氟维司群组40例患者发生133例AE(53.3%))。分析显示,两组的AE(p=0.220)或SAE(p=0.989)发生率相似。DRAE(p=0.960)和严重DRAE(p=0.969)的发生率也没有显著差异。
与氟维司群治疗相关的最常见AE为关节痛(6%)、咳嗽(4.5%)、上呼吸道感染(4.5%)、中性粒细胞减少(4.5%)和潮热(4.5%),而与依西美坦相关的AE为左后腰部钝痛(4.8%)、发热(3.9%)、咳嗽(2.9%)、低蛋白血症(2.9%)、高血糖症(2.9%)、关节痛(1.3%)和潮热(1.3%)。
研究结论
对于早期阶段接受过辅助NSAI治疗>2年的ER+/HER2-晚期乳腺癌患者,氟维司群一线治疗相比依西美坦,能显著延长PFS、TTF以及ORR。
专家点评
一、氟维司群是晚期一线治疗优选方案
1.单药探索
FIRST作为II期非盲研究最早证实了氟维司群在ER+/HER2-晚期乳腺癌中的一线治疗价值,其结果可以说振奋人心,随后的III期FALCON研究成果又再传佳绩,同样丰富了氟维司群晚期一线治疗的循证证据。但是需要理性分析的是,FALCON研究既往纳入患者从未接受过内分泌治疗,但在临床实践中面临的大多数绝经后ER+/HER2-晚期乳腺癌患者均为在早期阶段辅助内分泌治疗后出现复发或转移,基于这种考虑,FALCON研究结果似乎不够有说服力。
在上述背景下,FRIEND研究应运而生,纳入患者既往接受过≥2年辅助NSAI治疗,更加贴合临床实际,并且从研究数据上看,氟维司群一线治疗相比依西美坦显著延长HR+/HER2-晚期乳腺癌患者的中位PFS(8.5和5.6个月),且安全性得到保证。研究结果意味对于post-AI绝经后ER+/HER2-乳腺癌患者而言,氟维司群相比换用另一种AI可能是更加合理的治疗选择,这一点具有重要临床指导意义。
总体而言,FRIEND研究在既往FIRST、FALCON研究基础上进一步证实了氟维司群的一线治疗获益,并且从目前的内分泌单药研究进展来看,不管患者既往是否接受过内分泌治疗,氟维司群都是ER+/HER2-晚期乳腺癌单药内分泌治疗的优选,为晚期不适合接受CDK4/6抑制剂治疗的患者提供新的治疗选择。
2.联合CDK4/6抑制剂
目前对于HR+/HER2-晚期乳腺癌患者而言,CDK4/6抑制剂+内分泌治疗是国内外指南共同推荐的一线治疗标准方案。其中在MONALEESA-3研究中对于一线内分泌敏感人群,瑞波西利+氟维司群获得了迄今为止最长的中位PFS(长达33.6个月)[5]。此外,2022年ESMO BC公布的MONALEESA-3研究一线亚组OS更新结果显示[6],瑞波西利+氟维司群赢得了ER+/HER2-晚期乳腺癌治疗领域迄今为止最长的OS(67.6个月)。相比其他CDK4/6抑制剂+AI的晚期一线治疗方案显示出更优生存获益,该研究结果为临床医生选择CDK4/6抑制剂的最佳内分泌联合拍档提供了思路。
二、对于AI耐药的ESR1突变患者,含氟维司群的治疗方案是优选
既往研究表明,由于ERα表达缺失、共调节因子改变或生长因子信号通路中ERα交叉串扰,几乎所有ER阳性转移性乳腺癌患者均会出现内分泌治疗耐药[1]。ERα属于ER的亚型之一,是配体依赖性转录因子,由ESR1基因编码,因而ESR1基因突变被认为是潜在的内分泌治疗耐药机制[7]。国内有研究者报道,在内分泌治疗耐药,尤其是AI耐药的ER+/HER2-转移性乳腺癌患者中,ESR1基因突变发生率高达30%-40%[8]。
一项Meta分析[9]显示,对既往接受过AI治疗的ER阳性转移性乳腺癌患者的血液样本ESR1突变进行分析,将对进一步选择内分泌治疗具有临床指导意义。例如在III期PADA-1试验[10]中,对于早期接受CDK4/6抑制剂+AI治疗进展的患者,若检测到ESR1突变,观察到换用CDK4/6抑制剂+氟维司群相比继续接受CDK4/6抑制剂+AI治疗,能实现ER+/HER2-晚期乳腺癌患者中位PFS的双倍获益(11.9个月和5.7个月,HR=0.61,95%CI 0.43-0.86,p=0.005)。另外,SoFEA及PALOMA-3试验的回顾性分析[11]显示,在AI治疗后,携带ESR1突变者对氟维司群治疗仍相对敏感,后续的SoFEA及EFECT联合分析[12]也证实了氟维司群在ESR1突变患者中的预后优势。
与上述研究结果一致,FRIEND研究也观察到氟维司群能为AI治疗耐药的ESR1突变患者带来更大治疗获益,对于ESR1突变亚组患者,氟维司群的中位PFS为8.7个月,在数值上优于依西美坦组的5.5个月。并且在ESR1野生型患者中,两组的中位PFS差异具有统计学显著性(8.5个月和5.8个月),即氟维司群的疗效并不受ESR1突变的影响。这些研究探索共同表明,既往接受过AI治疗的ESR1突变患者对氟维司群治疗相对敏感。提示临床上对于这类患者,可优先选择含氟维司群的治疗方案。
三、口服SERD在CDK4/6抑制剂治疗后时代展现出广阔应用前景
从当前的临床诊疗现状来看,CDK4/6抑制剂联合内分泌治疗在ER+/HER2-晚期乳腺癌中的地位日益显著,但是耐药也是CDK4/6抑制剂无法回避的问题。近年来,围绕CDK4/6抑制剂治疗进展后的用药选择,研究者展开了诸多探索,包括PI3K/AKT/mTOR抑制剂、CDK4/6抑制剂跨线治疗、西达本胺+内分泌治疗、口服SERD、新型ADC药物等都在CDK4/6抑制剂经治患者中显示出极具潜力的治疗价值。
其中口服SERD是通过化学结构修饰以改善ER降解化合物的溶解度和极性,并经过多次更新迭代,以进一步提高生物利用度的新型药物[13]。因其在用药方式上相比氟维司群更加便捷,能有效增加患者的治疗依从性,近年来已成为CDK4/6抑制剂治疗后时代中的热点探索方向。
2023年伊始,FDA就批准了首个口服SERD药物--Elacestrant用于携带ESR1突变的绝经后ER+/HER2-晚期乳腺癌患者二线治疗适应症,该药物获批主要是基于EMERALD研究成果[14],研究纳入既往接受过1或2次内分泌治疗的患者,所有患者均接受过CDK4/6抑制剂治疗,但接受过≤1次化疗。入组患者随机分配至Elacestrant(n=239)和标准内分泌治疗组(SOC,n=238,包括氟维司群,阿那曲唑,来曲唑或依西美坦)。研究的主要终点是总人群和ESR1突变患者中BICR评估的PFS。结果显示,总人群(HR=0.70,95%CI:0.55-0.88,P=0.002)和ESR1突变人群(HR=0.55,95%CI:0.39-0.77,P=0.0005)中,Elacestrant相比SOC组均能显著延长BICR评估的中位PFS。并且在次要分析中,当Elacestrant仅与氟维司群相比时,这种获益趋势仍得到维持。此外,在排除6例既往接受过氟维司群治疗并在试验期间接受氟维司群治疗的患者的分析中,在总人群(2.8个月vs 1.9个月)或ESR1突变队列(3.8个月vs 1.9个月)中,Elacestrant仍表现出显著的中位PFS获益。不仅如此,在主要分析中,Elacestrant与AI对比的亚组分析也显示出相似的趋势。该研究充分验证了口服SERD在ER+/HER2-晚期/转移性乳腺癌≥2线治疗(CDK4/6抑制剂经治)中的巨大潜力,与此同时,Elacestrant的成功上市也极大程度上为口服SERD的探索之路树立了莫大的信心。
同时另外一款口服SERD—Camizestrant在ER+/HER2-晚期乳腺癌中的表现同样令人振奋。其II期SERENA-2研究[15]在ER+/HER2-晚期乳腺癌患者中评估了不同剂量水平Camizestrant(75mg、150mg、300mg)相比氟维司群的疗效和安全性。2022年SABCS大会公布的结果显示SERENA-2研究达到主要终点。在总人群中,与氟维司群相比,两种剂量Camizestrant均可使PFS产生具有统计学意义和临床意义的改善,75mg组、150mg组和氟维司群组的中位PFS分别为7.2个月、7.7个月和3.7个月。亚组分析显示,在既往接受CDK4/6抑制剂治疗、伴肺/肝转移、ESR1突变以及有ER驱动疾病的亚组中,PFS获益趋势与总人群一致。本次更新的SERENA-2研究首次将Camizestrant与氟维司群进行头对头比较,并且在绝经后ER+/HER2-晚期乳腺癌患者中显示出更优PFS获益,研究结果充分表明Camizestrant有望成为CDK4/6抑制剂经治ER+/HER2-晚期乳腺癌患者的更加有效且便捷的治疗选择。
除了Elacestrant和Camizestrant这两款研发进度相对较快的口服SERD药物之外,其他还包括Amcenestrant、Giredestrant等口服SERD也正在紧锣密鼓的开展临床试验。总体而言,尽管口服SERD的探索之路并非一帆风顺,但是从目前的研究成果来看,这条道路仍然充满希望,未来值得期待。
最后值得强调的是,目前临床上针对CDK4/6抑制剂经治患者,尚无标准的治疗推荐。期待未来随着诸如Camizestrant等新型药物更多研究数据的披露,能进一步丰富临床治疗决策,从而更大程度提高ER+/HER2-晚期乳腺癌患者的治疗获益。
专家简介


