急性呼吸窘迫综合征(Acute respiratory distress syndrome, ARDS)一组病因存在较大异质性,以弥漫性肺炎和肺水肿为主要表现的临床综合征,通常会导致严重的急性呼吸衰竭。自1967年ARDS的概念提出至今,其定义一直存在修订。

表1 ARDS定义的演变
1)1988年Murray等通过肺损伤评分对ARDS进行诊断,该评分包括四部分:X线胸片表现,低氧血症评分(氧合指数),呼气末正压(positive end-expiratory pressure,PEEP),呼吸系统顺应性。该标准具有一定的局限性,如未排除心源性肺水肿导致的低氧,未涉及发病危险因素,以及判断预后能力差等。
2)1994年欧美共识会议(American European Consensus Conference,AECC)通过了AECC标准,得到了广泛认同。
3)2012年欧洲危重病医学会(European Society of Intensive Care Medicine,ESICM)、美国胸科学会(American Thoracic Society,ATS)、美国重症医学会(Society of Critical Care Medicine,SCCM)对AECC标准进行了修订,提出ARDS柏林标准,通过氧合指数对ARDS的严重程度进行了分级,并不再使用急性肺损伤(acute lung injury,ALI)的概念。
4)2023年, ATS公布了ARDS全球新定义:ARDS的定义被进一步扩展为:接受经鼻高流量治疗(流速≥30L/min)的急性低氧血症患者可诊断为ARDS;SpO2/FiO2≤315mmHg作为低氧血症的诊断标准;保留肺部浸润作为影像诊断标准。
· 一、急性呼吸窘迫综合征的病因 ·
急性呼吸窘迫综合征可由多种原因引起,包括传染性和非传染性触发因素;这些触发因素可因局部炎症直接肺损伤,也可因全身炎症和损伤导致的间接肺损伤。

1)各种病原体引起的肺脓毒症和非肺脓毒症均可导致ARDS,其中肺脓毒症是最常见的原因。
2)在非感染性原因中,最常见的是胰腺炎、胃内容物误吸和严重创伤性损伤伴休克和多次输血。
· 二、ARDS的发病机制 ·
ARDS的病理生理学是复杂的,包括肺部和全身的炎症和凝血多种重叠和相互作用途径的激活和失调。
·2.1 肺部与全身炎症性反应·
各种疾病诱发的肺内和全身过度活化的炎症反应是ARDS发病的基础。
当我们从损伤+全身性炎症反应综合征(SIRS)→全身炎症反应失控→器官功能障碍→多器官功能障碍综合征( MODS)的动态过程来看,此时可以注意到肺脏是唯一接受全心排血量的器官,除了受到原位产生的炎症介质损伤外,还受到循环中由全身各组织产生的炎性细胞和介质的损伤。肺泡巨噬细胞不但释放一系列炎性介质,还产生大量局部趋化因子,引起中性粒细胞等在肺内聚集,造成损伤。此外肺有丰富的毛细血管网,血管内皮细胞在局部炎症反应中起着积极作用。因此在全身炎症性反应的过程中,肺脏受损的时间早、程度重、发生快。
当炎症反应发生时,炎症级联可分为相互重叠的3个阶段,即启动、放大和损伤。
1)启动阶段:多种免疫与非免疫细胞产生释放各种炎症介质和细胞因子;
2)放大阶段:效应细胞如中性粒细胞被活化、趋化扣押在肺等靶器官中;
3)损伤阶段:效应细胞释放活性氧代谢产物和蛋 白酶等,引起靶细胞损害,主要表现在肺血管内皮细胞损伤造成肺微血管通透性增高和(或)肺泡上皮细胞的损害,引起大量富含蛋白质和纤维蛋白的液体渗出至肺间质和肺泡,形成非心源性肺水肿,透明膜形成,并伴肺间质纤维化。

图2肺水肿
· 2.2 肺泡-毛细血管屏障损伤·
肺泡-毛细血管屏障有两层,即微血管的内皮层和肺泡上皮层。前面提到,由于循环的原因,肺脏是感染或创伤时最易受损的器官,而肺血管内皮细胞又是最早受损伤的细胞,
1)血管内皮细胞有着复杂的代谢功能。ARDS时,肺毛细血管内皮细胞不仅是损伤的靶细胞,它们可以被多种因素激活,发挥活跃的代谢与调节功能,主动参与ARDS的发生、发展和转归。①激活的内皮细胞可生成释放IL-8、巨噬细胞炎性蛋白(MIP)-2、TNF-a、IL-IB、PAF等,使更多的白细胞从循环到炎症部位;②可分泌前列腺素、内皮素、一氧化氮 ,影响血管舒缩功能;③并生成血管性假血友病因子、纤溶酶原激活物抑制剂,引起凝血亢进而促进血栓形成。
另一方面,受损的内皮细胞代谢、灭活性物质能力下降,也能引起血液中某些物质(如ET)水平增高。
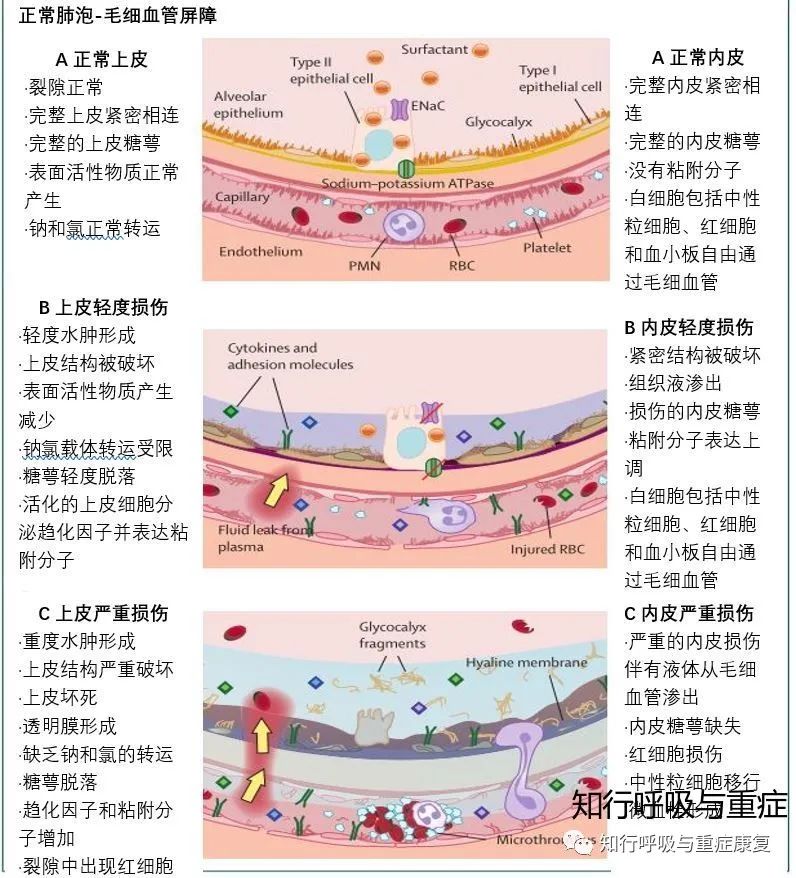
2)肺泡上皮组织主要由肺泡I型和II型上皮细胞组成两种细胞对于宿主的防御和免疫都有重要作用。相对而言,I型细胞对损伤更敏感,细胞也更容易死亡;而II型细胞对损伤较为耐受,且可以增殖分化为I型细胞,对于肺泡上皮屏障的形成和修复有重要意义。这些细胞还可以产生表面活性物质和调节出肺泡的液体平衡。肺泡上皮细胞受损屏障破坏、生成表面活性物质减少以及从肺泡腔运出离子和液体的能力降低,是引起肺泡水肿、肺泡塌陷的重要因素:上皮的损伤容易继发肺纤维化和细菌性肺炎;此外,肺泡机械牵拉时上皮细胞还可产生细胞因子放大炎症反应。
· 三、ARDS的管理策略 ·
ARDS的治疗应从感染、创伤的早期开始,其原则为纠正缺氧,提高全身氧转运,维持组织灌注,防止组织脏器进一步损伤。在治疗上可分为病因治疗和支持治疗。
1)支持治疗:支持治疗包括器官功能及全身支持治疗,特别是呼吸支持治疗,“等待”肺损伤缓解。
2)病因治疗:对于ARDS的基本病理生理改变(肺毛细血管通透性增加和肺泡上皮受损)及ARDS发病的根本原因(炎症反应)均缺乏特异而有效的治疗手段
3)临床常用的治疗策略包括通气策略、俯卧位、体外支持、神经肌肉阻断和激素使用等
· 3.1 病因治疗·
1)控制感染:控制感染的措施主要包括充分引流感染灶、有效地清创和使用合理的抗菌药物。当然,腹腔、肺部感染的迁延,急性胰腺炎的发展等都使病因治疗相当困难。2)调控机体炎症反应:ARDS作为机体过度炎症反应的后果,全身性炎症反应是其根本原因,调控炎症反应不但是ARDS病因治疗的重要手段,而且也可能是控制ARDS、降低病死率的关键。其中糖皮质激素在ARDS治疗中的作用一直存在争议。其具有有效的抗炎作用,理论上是针对ARDS根本原因的治疗。但早期的RCT结果提示,大剂量糖皮质激素既不能预防ARDS的发生,对早期ARDS也没有治疗作用,因此目前不推荐常规使用糖皮质激素预防和治疗ARDS。
· 3.2 呼吸支持·
1)肺保护性通气:即潮汐气量<6 ml/kg,预测体重,平台压≤30mmHg,是基于具有里程碑意义的ARMA试验结果的关键建议,可降低死亡率并不增加机械通气天数。

①PEEP设定:指南建议为中重度ARDS患者保留高PEEP,在公众号往期文章已有整理(点击跳转原文)→第149期 滴定PEEP的9个方法
②驱动压设置:驱动压(即平台压减去呼气末压)是ARDS患者生存的独立预测因子。Amato及其同事表明,驱动压是PEEP和潮气量策略获益的关键调节因子。推荐的驱动压力上限为15cmH2O,超过这个上限会造成相当大的肺压力时死亡率会增加。
③机械功率:机械功率计算公式为:功率(J/min)= 0.098 ×潮气量×呼吸频率× [PEEP + 1/2驱动压力+(气道峰压-平台压)]。与单个呼吸机参数相比,机械功率可能是更好的肺保护性通气驱动因素,因为它考虑了这些参数的整体平衡。临床试验和观察数据的再分析表明,机械功率与死亡率有关。在一项包括8207例患者的回顾性分析中,机械功率大于17J/min时,死亡风险持续增加。
2)俯卧位通气:ARDS患者俯卧位可改善氧合,增加复吸潜力,减少肺泡过度扩张面积,从而确保肺部更均匀的通气,并可能减少呼吸机引起的肺损伤。

表2 俯卧位实施方案
3)ECMO治疗:重度ARDS患者(定义为PaO2/FiO2比值<50mmHg>3h, PaO2/FiO2比值<80mmHg>6h,或重度高碳酸血症性呼吸衰竭[即pH<7.25, PaCO2≥60mmHg>6h])建议采用ECMO治疗。
· 3.3 液体管理·
疾病早期炎症因子大量释放,往往导致血管舒张、血容量不足、心肌抑制、代谢需求增加及组织氧利用障碍进一步诱发器官功能障碍(包括ALI),此时组织灌注不足,往往需要进行液体复苏纠正休克并维持组织灌注。一旦机体炎症反应和抗炎反应的平衡恢复,机体恢复内稳态,休克纠正,心排血量增加,组织灌注恢复正常。此时应积极实施限制性液体管理策略,使血 管外液体尽快回流,减轻组织水肿。因此,ARDS液体管理应该采取保证充分的灌注的前提下限制性液体管理策略。
· 3.4 营养支持·
ARDS患者处于高代谢状态,能量消耗增加。如果营养摄入不足,易造成营养不良,影响组织修复能力;免疫力下降,易继发感染。

图4 危重症患者的营养干预
因此,应早期适量以合适的营养途径给予患者营养支持。危重症患者营养相关内容在往期文章已有整理(点击跳转原文)
→第103期 高分解代谢-危重症患者代谢与营养变化特点→如何评估重症患者的营养风险?从这7个维度全面判断![第105期 ]
→第107期 一文掌握重症患者营养支持的时机、途径以及供给量
· 3.5 未来进展·
1)药物治疗:许多研究ARDS患者药物干预的临床试验没有显示出益处。没有显示出益处的特定药物包括吸入前列腺素、他汀类药物、阿司匹林、肺泡表面活性物质、活化蛋白C。其他药物包括β-2激动剂和角质细胞生长因子,虽然目前临床数据很有希望,但也有潜在的危害。
2)骨髓间充质干细胞/内皮祖细胞是治疗ARDS的一种新方法。这些多能的、可塑的细胞来自骨髓、脐带或脂肪组织,可分化为肺上皮细胞、肺血管内皮细胞,并具有多效性的免疫调节、修复和抗菌作用。

图5 ARDS治疗的未来方向
· 参考文献 ·
[1]杜欣欣,潘鹏飞,于湘友. 急性呼吸窘迫综合征的定义:昨天,今天,明天. 中华急诊医学杂志,2023,32(08):1023-1027. DOI:10.3760/cma.j.issn.1671-0282.2023.08.003
[2]Meyer NJ, Gattinoni L, Calfee CS. Acute respiratory distress syndrome. Lancet. 2021 Aug 14;398(10300):622-637. doi: 10.1016/S0140-6736(21)00439-6. Epub 2021 Jul 1. PMID: 34217425; PMCID: PMC8248927.
[3]孙同文,张西京,黎毅敏等.中国成人急性呼吸窘迫综合征(ARDS)诊断与非机械通气治疗指南(2023)[J].中国研究型医院,2023,10(05):9-24. DOI:10.19450/j.cnki.jcrh.2023.05.002
[4]Bos LDJ, Ware LB. Acute respiratory distress syndrome: causes, pathophysiology, and phenotypes. Lancet. 2022 Oct 1;400(10358):1145-1156. doi: 10.1016/S0140-6736(22)01485-4. Epub 2022 Sep 4. PMID: 36070787.
[5]Gorman EA, O'Kane CM, McAuley DF. Acute respiratory distress syndrome in adults: diagnosis, outcomes, long-term sequelae, and management. Lancet. 2022 Oct 1;400(10358):1157-1170. doi: 10.1016/S0140-6736(22)01439-8. Epub 2022 Sep 4. PMID: 36070788.
