
解析 HER2 表达的常见和不常见模式、异质性发生情况以及计算病理学在评估 HER2 模式中的可能作用。
HER2 是乳腺癌领域探索靶向治疗生物标志物的最成功案例,基于“癌基因成瘾”的概念,即某些肿瘤细胞依赖于某一个持续激活的致癌信号通路来维持其恶性增殖存活的现象,使得识别出从抗 HER2 治疗药物中获益的患者成为可能。由于 HER2 基因扩增导致细胞膜上 HER2 受体明显过表达,使用经临床验证的抗体和基于细胞膜表面受体表达强度和完整性的评分系统进行免疫组织化学(IHC)检测,构成了区分 HER2阴性(IHC 评分 0/1+)和阳性(IHC 评分3+)肿瘤的筛选方法,同时能够识别出 HER2 蛋白完整但仅中度表达的肿瘤(IHC 评分 2+,待明确),而这需要从基因状态方面进一步研究,以证实其与“癌基因成瘾”存在相关性。
发表在《Pathobiology》上的一篇综述报道[1]中,从经典的 HER2 评估到HER2 表达不常见和/或难以定义的模式均进行了详细描述,并且结合理论与实践,重点阐述了 HER2 异质性、HER2 在新辅助治疗后丢失或从原发性乳腺癌向复发性/转移性乳腺癌的演变过程中发生转化以及 HER2 低表达乳腺癌新类别的相关内容。现将该综述中有关 HER2 表达模式、HER2 异质性发生情况以及计算病理学在评估 HER2 模式中的可能作用相关内容梳理如下,以飨读者。
1“通过指导原则”评估 HER2 表达:常见和异常模式
通过结合 IHC 评估蛋白表达水平和原位杂交(ISH)评估基因扩增共同表征 HER2 状态。尽管可以直接采用ISH,但大多数病理学实验室首先采用 IHC 筛查来评估 HER2(过度)表达的程度,然后在模棱两可的病例中再进行 ISH 检测。基于细胞膜染色的强度和完整性,以及染色阳性细胞百分比设计评分系统,包括以下评分情况:
评分为 0(阴性),无染色或≤10%的浸润癌细胞呈现不完整的、微弱的细胞膜染色(图 1);
评分 1+(阴性),>10%的浸润癌细胞呈现不完整的、微弱的细胞膜染色(图 1);
评分 2+表示模棱两可的病例,>10%的浸润癌细胞呈现弱-中等强度的、完整细胞膜染色,或≤10%
的浸润癌细胞呈现强而完整的细胞膜染色(图 1);
评分为 3+(阳性),>10%的浸润癌细胞呈现强、完整、均匀的细胞膜染色(图 1)。
对于 IHC 评分为 2+的病例,必须使用 ISH 针对同一样本进一步检测,或使用IHC 或 ISH 针对新样本重新检测。在需要进行 ISH 检测的 IHC 2+病例中,约25%的病例出现 HER2 扩增。
由于膜染色强度的评估受人眼感知的影响,尤其是在区分 IHC 评分 1+和 2+时,评分判读的主观性可能导致病理学家和/或机构之间的结果不一致。鉴于HER2 IHC 检测评分在指导治疗中的核心作用,部分学者制定了所谓的放大规则[2],即使用目标值的不同放大倍数对评分进行分类:
在低倍镜(×2.5–×5)下观察到的清晰的强染色判读为 3+;
在 10-20 倍镜下可观察到的染色很可能符合 2+;
而当需要 40 倍物镜来识别一些染色时,应判读为 1+。
该规则对于病理学家十分有利,并可能提高 IHC 评分的重现性,尤其是引入新类别--HER2 低表达乳腺癌时。部分国家指南已经在乳腺癌和胃癌中实施了该规则。
ASCO/CAP 指南承认存在不完全符合上述定义的染色模式,但应对其进行相应识别和分类(例如评分 2+),以免遗漏可能的 HER2 扩增肿瘤。HER2 表达的异常模式主要分为两类,一类是IHC 染色为中度至强度但不完整(基底外侧或外侧)的典型病例,一类是 HER2 过表达程度有限的典型病例。
 图 1.乳腺癌基于 IHC 检测评估的 HER2 表达状态
图 1.乳腺癌基于 IHC 检测评估的 HER2 表达状态第一类的典型示例是微乳头状癌,通常表现出所谓的 HER2 表达的 U 形模式,以细胞膜的基底外侧内衬为特征(图 2)。表达强度可能不同,通常为中度至强度;然而,由于沿细胞膜缺乏完整性,这种基底外侧模式甚至不符合评分 2+的标准。但是考虑到这些癌种中,大约 30%的病例携带 HER2 扩增,因此仍将其视为 2+,并需要进行 ISH检测。

图2.微乳头状癌中HER2阳性的异常模式
通常,当遇到 HER2 表达为中度至强度基底外侧或外侧模式时,无论组织学类型如何,病例均应进行 ISH检测。在具有广泛性腺体特征的乳腺癌病例中同样检测到基底外侧/外侧模式(图 3)。

图 3. 乳腺癌中基于 IHC 评估的常见和不常见的 HER2 表达模式
第二类 HER2 表达异常模式以乳腺癌为代表,显示出强度且周围均为 HER2 过度表达的肿瘤细胞比例非常有限。换句话说,这些乳腺癌表现出 HER2 表达强度评分为 3+特征的区域。然而,由于 HER2 阳性肿瘤细胞群的范围非常有限(<10%),它们不能被归类为 3+(图 3,图 4)在这种情况下,应进行 ISH 检测,以确定侵袭性肿瘤内 HER2 基因扩增的程度。建议检测额外的组织块(如可用)和/或其他样本(通常为淋巴结转移),以解释这些高度异质性肿瘤中 HER2 扩增的有效程度。如果 HER2 扩增占比低于10%,则该病例评分为 HER2 阴性。一个实用的方法是在报告中注释这种有限的 HER2 阳性组分的存在,以建议当患者在自然病程中复发或转移的情况下,及时准确重新评估 HER2 状态。
目前,尚无特定研究阐述 HER2 异常表达模式对 HER2 正确判读的影响。然而,从实践的角度来看,每当观察到 HER2 异常表达模式时,可能需要进行ISH 检测以排除 HER2 扩增的任何可能性,从而增加 ISH 检测的总体数量。最后,值得一提的是,偶尔会遇到细胞质颗粒染色(例如,在大汗腺癌中),以及细胞核染色(通常与细胞质染色结合)和基膜模式或假腔染色(在高分化乳腺癌中):最好认为这些类型的染色是人为造成,而与 HER2 基因改变无关。
2HER2 表达异质性模式的挑战
乳腺癌存在 HER2 表达/扩增异质性,其发生率为 1%-40%。众所周知,HER2表达/扩增的异质性具有三种主要模式:其中包括两种不同的肿瘤细胞克隆,一种携带 HER2 扩增,另一种具有正常的 HER2 表达状态(“聚集型或克隆型”),最后一种也是最为常见的模式,即 HER2 阴性肿瘤细胞群中具有不同HER2 表达状态的混杂细胞,可以是弥漫性的,也可以是仅有分散的分离 HER2扩增细胞(“镶嵌型”)。
当加深对乳腺癌中 HER2 异质性发生率的分析时,既往报告显示,与镶嵌型相比,聚集型更为罕见;然而,尽管许多研究报告了 HER2 异质性的发生率,但很少有研究明确所观察到的异质性类型的颗粒状数据(聚集型与镶嵌型)。针对来自本机构的未经选择的乳腺癌系列(在 2021 年诊断的病例,根据最新的ASCO/CAP指南更新报告)数据进行审查,以确定 HER2 异质性的类型,结果发现:
在未经选择的队列(即,所有新诊断的乳腺癌)中,存在 0.01%的聚集型HER2 异质性;
在所有评分为 3+和 2+(仅限于 2+评分病例进行 ISH 检测)的病例中,存在 4%的聚集型 HER2 异质性;
在所有阳性病例中,存在 10%的聚集型 HER2 异质性;
相反,在 3%的未经选择队列和 15%的 3+和 2+(仅限于 2+评分病例进行ISH 检测)评分队列中观察到镶嵌型 HER2 异质性。
据报道,HER2 异质性在 ISH 和/或 IHC 检测 HER2 状态不明确的病例中也十分常见,部分学者认为,HER2异质性是 ISH 和 IHC 检测乳腺癌 HER2 状态不明确的重要原因。本研究已经证明,当评估 HER2 扩增和未扩增细胞弥漫性混合型乳腺癌中 HER2 状态时,总体评分导致 HER2 计数不明确[3],即 Press 等人报告的基于 ISH 检测评估的第 4 种 HER2 异质性模式。值得注意的是,在这些情况下,HER2 信号>6 的细胞通常具有低水平的 HER2 扩增。
聚集型 HER2 异质性更容易定义,因为肿瘤细胞群是明确的,并且在 IHC 和ISH 的基础上易于识别。这种模式也表明在一个病灶或一种“碰撞肿瘤”中存在两种不同的肿瘤类型。一个肿瘤细胞群是否可能来源于另一个尚未得到证实。一项利用基因拷贝数(CN)分析和大规模平行测序的基因组研究分别分析了 12 例HER2 异质性乳腺癌的 HER2 阴性和 HER2 阳性成分,并确定了仅限于 HER2阴性细胞的潜在驱动基因改变,由此表明 HER2 阴性组分可能是由 HER2 阳性组分中不存在的基因改变所驱动[4]。
指南考虑了这种聚集型异质性的情况,建议当 HER2 阳性人群代表整个病变的至少 10%时,单独报告这些人群。这些病例的重要性体现在与治疗决策相关,因为肿瘤学家需要应对具有不同样本特征的肿瘤患者的治疗需求,与单纯 HER2 阳性和 HER2 阴性肿瘤相比,其治疗反应可能存在差异。这种影响在新辅助治疗中非常明显,在新辅助治疗中,HER2 状态是通过空芯针活检样本评估的,因此,病灶样本对于给予正确的治疗至关重要(图 4)。病理学家和放射科医生在这种情况下需要紧密沟通,以获得最具代表性的组织材料。建议检查多个空芯针穿刺部位,以充分获得肿瘤病变样本,并保证正确分配肿瘤细胞的组织学类型和表型。
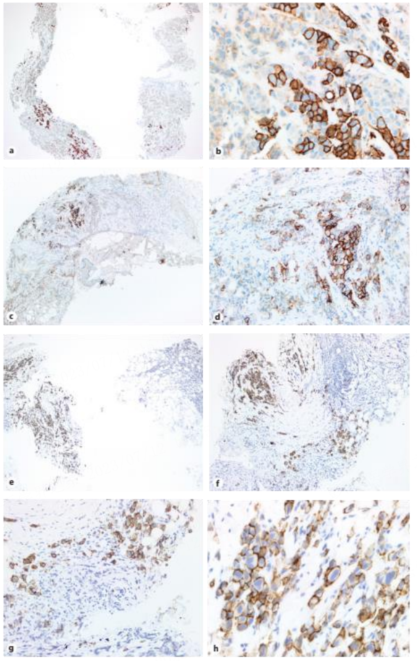
图 4. 空芯针活检样本中的 HER2 异质性
值得注意的是,如果患者接受新辅助化疗后获得 pCR,则空芯针活检样本将代表与原发性肿瘤相关的、可用于任何进一步评估的唯一材料。
如果通过适当的病灶采样以正确捕获 HER2 异质性,新辅助治疗则提供了评估抗 HER2 治疗反应程度的机会。最近的一项 II 期新辅助临床试验提供了 HER2 异质性对 HER2 阳性早期、异质性乳腺癌治疗反应影响的数据[5]。对空芯针活检样本进行仔细检查,以确定具有不同 HER2 状态(阳性和阴性)的不同肿瘤细胞群。在 10%的可评估病例(16/157)中检测到 HER2 异质性(定义为>5%但<50%的肿瘤细胞中 HER2 扩增的区域,或 FISH 检测到 HER2 阴性区域)。本研究计划采用 T-DM1 联合帕妥珠单抗进行新辅助治疗,观察到 HER2 异质性肿瘤均未达到 pCR,而在非异质性亚组中观察到的 pCR 率为 55%(p值<0.0001,校正激素受体[HR]状态)。这些数据表明,HER2 未扩增癌细胞的占比是 HER2 异质性乳腺癌接受抗 HER2治疗耐药的强预测因子。因此,在优化治疗策略时,应考虑 HER2 表达的异质性。
镶嵌型 HER2 异质性可以表现为分散的 HER2 阳性细胞或具有不同 HER2 表达和/或基因状态的细胞群弥漫性混杂。这种模式更常见,通常存在于 HER2 评分 2+病例中(图 5)。在 FISH 分析中,这些癌症的一个亚组可能显示肿瘤细胞与 HER2 拷贝数增加的混合物。通常,由于两种诊断试验的结果均不明确,这些病例将被归类为“HER2-双模棱两可”。值得注意的是,IHC 染色可能呈现弥漫性和中度染色,ISH 分析通常突出显示 HER2 拷贝数在 6-10 或以上的不同比例的肿瘤细胞[3]。在诊断实践中,病例本身可能具有相当大的挑战性,因为不会遗漏从潜在的解救治疗(如抗 HER2 药物)方案中获益的患者。本研究没有关于抗HER2 治疗在此类患者中可能获益的可靠数据。因而在接受含曲妥珠单抗的新辅助化疗的患者队列中进行了一项假设生成研究,观察到 HER2 异质性双重模棱两可病例的 pCR 率显著低于 HER2 阳性(评分 3+)病例患者(10%vs.60%,Fisher 精确检验,p=0.009)[3]。3 例病例显示接近 pCR(微小残留病[RD]/接近总效应/剩余肿瘤<10%)。当对 pCR 和接近 pCR 病例进行分组时,双重模棱两可和评分 3+病例之间的缓解率差异无统计学显著性(40%vs.63.3%,p=0.27)。然而,该研究不能排除这是由于化疗的有益作用,因为该发生率与仅接受化疗的雌激素受体阳性/HER2 阴性患者队列中累积的发生率无显著差异[3]。
有必要进行更大规模的研究,以比较接受相同化疗方案±曲妥珠单抗治疗的 HER2 异质性乳腺癌患者,从而确定抗 HER2 治疗在特定乳腺癌亚组中的实际影响。根据 ASCO/CAP 关于 HER2 检测建议的最新更新,HER2 ISH 不明确病例应报告为“阴性”,除非 HER2 表达模式达到 3+评分。这一建议依赖于这样一个事实,即目前没有足够的证据表明,在没有蛋白过表达的情况下,每个细胞平均 4-6 个 HER2 信号和HER2/CEP17 比值<2.0 的患者是否从 HER2 靶向治疗中获益。因此,当 IHC 评分不为 3+(HER2 阳性)时,建议将样本视为 HER2 阴性,并应添加备注以说明结果。
3计算病理学在评估 HER2 模式中的可能作用
由于全切片成像的可用性,在自动图像分析算法方面具有积极作用,同时也应用于 IHC 切片上 HER2 表达的定量。这一需求源于这样一个事实:即使采用指南/建议,仍存在具有挑战性的病例,尤其是针对不同评分状态的临界 HER2 评估。比较病理学家和计算机辅助方法之间 HER2 评分的研究显示,两者具有同样的准确性和可重现性。
有研究报告了 3+和 0/1+的良好一致性,而 2+被证明是最存在问题的类别。已证明某些工具可识别 2+病例,但程度低于人眼。计算机辅助 IHC 评分的实施使 FDA 批准了其中许多算法,2019 年,美国病理学家学会发布了使用定量图像分析(QIA)提高乳腺癌 HER2 判读的准确性、精确度和重现性的建议[6]。在诊断实践中实施基于 QIA 的 HER2 评估系统的过程中,读者应参考这些建议。该指导原则明确指出,实施前需要经过验证的程序,并且质量控制/保证是强制性要求。值得注意的是,使用 QIA 系统进行 HER2 检测的性能、判读和报告应由具有该领域专业知识的病理学家监督[6]。因此,QIA 可用作病理学家的辅助工具,以实现一致的判读,报告中 QIA 的使用应得到认可[6]。然而,也有报告称,计算机辅助 IHC 评分系统在某些类型的样本(如异质性染色切片)中似乎表现不佳;因此,尚未证明这些计算机辅助系统评估 HER2 异常模式的可靠性。
未完待续,有关 HER2 低表达乳腺癌新类别以及 HER2 表达状态在肿瘤疾病演变过程中或者新辅助治疗前后发生变化、检测前阶段及其针对不同类型组织样本中 HER2 表达评估的影响等相关内容,详情请见深度探讨乳腺癌中 HER2 表达模式(下篇)
参考文献[1] Grassini D, Cascardi E, Sarotto I, et al. Unusual Patterns of HER2 Expression in Breast
Cancer: Insights and Perspectives. Pathobiology. 2022;89(5):278-296.
[2] Scheel AH, Penault-Llorca F, Hanna W, et al. Physical basis of the “magnification rule”
for standardized Immunohistochemical scoring of HER2 in breast and gastric cancer.
Diagn Pathol. 2018 Mar 12;13(1):19.
[3] Marchio C, Dell’Orto P, Annaratone L, et al. The dilemma of HER2 double-equivocal
breast carcinomas: genomic profiling and implications for treatment. Am J Surg Pathol.
2018 Sep;42(9):1190–200.
[4] Ng CK, Martelotto LG, Gauthier A, et al. Intra-tumor genetic heterogeneity and
alternative driver genetic alterations in breast cancers with heterogeneous HER2 gene
amplification. Genome Biol. 2015 May 22;16:107.
[5] Filho OM, Viale G, Stein S, et al. Impact of HER2 heterogeneity on treatment response
of early-stage HER2-positive breast cancer: phase II neoadjuvant clinical trial of T-DM1
combined with pertuzumab. Cancer Discov. 2021;11(10): 2474.
[6] Bui MM, Riben MW, Allison KH, Chlipala E, Colasacco C, Kahn AG, et al. Quantitative
image analysis of human epidermal growth factor receptor 2 immunohistochemistry
for breast cancer: guideline from the college of American pathologists. Arch Pathol
Lab Med. 2019 Oct;143(10):1180–95.
材料由阿斯利康支持,仅供医疗卫生专业人士参考
审批编号:CN-118058 过期日期:2024-7-9
* 此文仅用于向医学人士提供科学信息,不代表本平台观点

