*仅供医学专业人士阅读参考

咖啡因为伴侣,味道更易接受。化疗因为它,患者耐受性更高。
小细胞肺癌(SCLC)属于一种低分化神经内分泌瘤,在肺癌患者中占比约15%,其早期对放疗和化疗手段极为敏感,故而放化疗是治疗SCLC的较为常用的手段[1]。但多数化疗药物为细胞毒性药物,在杀死癌细胞的同时,也会对人体其他器官、组织造成不同程度的损伤,尤其是造血细胞[2]。有研究指出,肿瘤患者化疗后骨髓抑制的发生率约为30%~50%,骨髓抑制甚至还可增加内脏出血、感染、休克等风险,且在老年患者中尤为严重[3]。化疗造成的骨髓抑制等不良反应,可使患者常因不能耐受而中止治疗,导致影响整体治疗效果。曲拉西利是一种细胞周期蛋白依赖性激酶4/6(CDK4/6)抑制剂,有研究表示,曲拉西利可有效预防中性粒细胞减少、血小板减少和贫血症状,可针对化疗导致的骨髓抑制提供多系保护,且对化疗的抗肿瘤作用没有影响[4,5]。此前,深圳市人民医院吴迪教授为我们分享了一例曲拉西利联合化疗一线治疗SCLC的病例。为此,医学界特邀吴迪教授对此例病例进行回顾及点评,小编进行了详细梳理,以飨读者。
本病例亮点:
1.曲拉西利联合免疫治疗与化疗方案安全性高。本病例为老年患者,老年素来体虚,化疗耐受性低,但在第2疗程治疗前加用曲拉西利,并连续应用3个治疗周期后,患者一方面同样取得了很好的治疗效果,患者并未对抗肿瘤治疗产生负面影响,另一方面患者在治疗期间无严重不良反应发生,说明该治疗方案安全性高且对原免疫治疗+化疗效果无干扰。
2.曲拉西利护髓疗效持续稳定。患者在第一程化疗后出现严重贫血,从化疗第二周期加入曲拉西利后,使得患者的贫血状态逐渐恢复,且保证化疗连续进行3个周期,说明曲拉西利护髓疗效持续稳定。
3.该病例资料收集完善,实验室检查及影响检查数据完善,可以很清晰的观察到各个治疗周期的血项及影像学变化。
患者信息
| 一般信息
患者男,70岁。
主诉:发现肺部占位一月余现病史:患者1月余前于我院行胸部增强C发现肺部占位,遂于我科住院治疗,经查诊断为恶性肿瘤维持性化学治疗恶性肿瘤免疫治疗左肺小细胞癌伴纵隔、双侧锁骨上、左侧颈部、肠系膜、腹腔、腹膜后多发淋巴结、头颅转移可能T4N3M1cⅣB广泛期。行第1周期依托泊苷(D1-D3)+卡铂+斯鲁利单抗抗肿瘤治疗后出院,出院后患者无胸闷胞痛、无咯血,无发热、无呕血、黑便等不适。患者2天前无明显诱因出现咳嗽,咳少量白痰,无发热,未用药,现患者为行第2周期依托泊苷+卡铂+斯鲁利单抗抗肿瘤治疗来我院,门诊以“肺恶性肿瘤”收住我科。此次起病以来,患者胃纳、睡眠、精神可,二便正常,近1月体重未见明显变化。
既往史:既往有高血压病史20余年,最高血压180mmHg,平素服用“苯磺酸氨氯地平5mg qd”,血压控制可。自测随机血糖10.55mmol/L,未予特殊治疗。否认冠心病,否认肝炎,结核等传染病史。否认输血,外伤史,否认已知食物,已知药物过敏史。
婚育史:无特殊。
个人史:生于原籍,否认长期外地居住史,否认特殊化学品及放射性接触史。吸烟50余年,2包/日,戒烟3月。饮酒50年,半斤/日,戒酒3月。确诊“梅毒”1个月。
家族史:家族中否认遗传病,传染性疾病及类似病史。
体格检查:无异常。
| 辅助检查
实验室检查:2023年1月26日,我院查血常规:白细胞计数6.66×109/L,红细胞计数2.66×1012/L,血红蛋白78g/L,中性粒细胞比值89.5%。C反应蛋白109.6mg/L。复查肾功能:尿素氮9.75mmol/L,肌酐84μmol/L,肾小球滤过率80.78ml/(min·1.73m2)。肝功能:谷丙转氨酶17U/L,谷草转氨酶28U/L,总蛋白58.7g/L,血清白蛋白26.6g/L。血电解质:钾3.93mmol/L,钠131.7mmol/L,钙1.99mmol/L,B型钠尿钛前体(pro-BNP)233.20pg/mL,乳酸脱氢酶277U/L,降钙素原3.02ng/mL。
2023年2月7日,外院查血常规:白细胞计数3.98×109/L,红细胞计数2.82×1012/L,血红蛋白80g/L,中性粒细胞比值51.3%,中性粒细胞计数2.04×109/L。
| 影像学检查:
表1 患者影像学检查报告
检测时间
检测方式
检测结果
2022.12.29
胸部CT
1.考虑双肺多发炎症,请结合临床治疗后复查。
2.右下肺术后改变,右侧胸腔积液较前稍减少。
3.双肺小结节显示不清,建议继续随访;主动脉及冠状动脉钙化。
2022.12.30
双下肢静脉超声
双侧下肢深静脉未见明显异常声像
心脏超声
1.主动脉硬化。
2.二尖瓣轻度反流。
2023.1.3
床边胸片
1.双肺多发炎症,主动脉硬化,右下肺术后改变,两侧胸腔积液。
2.右侧输液港留置,管端位于胸3右下缘。
3.请结合临床考虑。
2023.1.9
胸部CT平扫
1.双肺多发炎症、较前略吸收,请结合临床。
2.右下肺术后改变,右侧胸腔积液同前。
3.双肺小结节显示不清,建议继续随访。
4.主动脉及冠状动脉钙化。
2023.1.12
心脏彩超
1.主动脉硬化。
2.主动脉瓣及二尖瓣退行性变。
3.静息状态下未见明显室壁运动异常。
4.左室舒张功能减低,左室整体收缩功能正常。
5.少量心包积液。
双侧甲状腺+颈部及锁骨上淋巴结超声
双侧颈部Ⅱ、Ⅲ、Ⅳ区及锁骨上可见异常肿大淋巴结,性质请结合临床。
2023.1.13
全身CT
支气管或肺恶性肿瘤
2023.1.17
胸片
1.双肺多发炎症,较前减少,右下肺术后改变,两侧胸腔积液。主动脉硬化。
2.侧深静脉输液港留置,管端位于胸3椎体水平右旁。请结合临床考虑。
| 诊断结果:
左肺小细胞癌伴纵隔、双侧锁骨上、左侧颈部、肠系膜、腹腔、腹膜后多发淋巴结、头颅转移cT4N3M1cⅣB广泛期。
| 治疗过程
治疗方案选用卡铂+依托泊苷+斯鲁利单抗,治疗周期为4个周期,每个周期为3周。患者在第1周期化疗后出现严重贫血,故在第2周期调整方案,加用曲拉西利,以期调整患者贫血状态,达到护髓效果,保障接下来第3及第4周期化疗的顺利进行,见图1。

图1 患者治疗期间用药方案
一线治疗各周期化疗前后血项具体数据对比患者在接受第2周期化疗前出现血红蛋白低,化疗化疗后血小板维持在正常范围内,且下降速度得到延缓,血红蛋白恢复。在接受第3周期化疗后,患者白细胞和中性粒细胞等各血项数据均调整在正常范围内,且保持稳定。说明曲拉西利有明显保护血红蛋白的作用,可保护骨髓造血干细胞祖细胞免受化疗药物的损伤,降低SCLC患者骨髓抑制发生率,改善患者对化疗的耐受性且不增加化疗安全风险,显示出多谱系骨髓保护的作用,可确保化疗顺利进行,见图2-5。

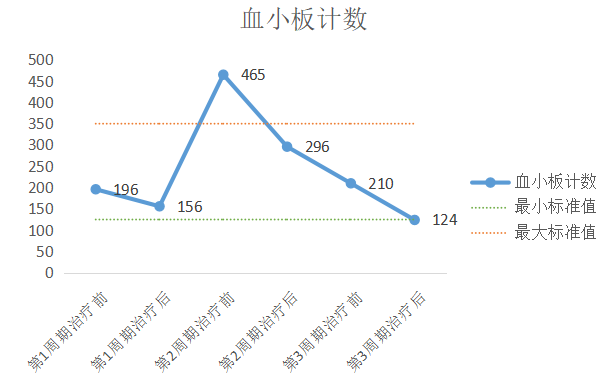


图2-5 患者治疗期间血红蛋白浓度、血小板计数、白细胞计数以及中性粒细胞绝对值变化(左右滑动)
| 随访结果
患者最近随访影像检测结果:


图6,7 患者1月9日、3月9日胸部CT影像(左右滑动)
专家点评
肺癌是全球疾病负担最重的恶性肿瘤之一,2020年全球范围内肺癌新发病例约220.7万例,约占所有癌症病例的11.4%,在常见恶性肿瘤中居第二位,病死率约占所有癌症死亡病例的18%,排名第一[1]。SCLC通常见于主支气管和叶支气管,具有高度恶性、生长快、侵袭力强的特点,且其转移发生较早,约2/3的患者在诊断时即发生远处转移,转移部位常见于淋巴结、对侧肺、脑、肝肾上腺、骨等[6],生存率较低,未接受积极治疗的患者5年生存率不足5%,平均总生存期仅为2~4个月[7,8]。SCLC对初始化疗呈现高度敏感性,故临床SCLC常推荐进行化疗。需要注意的是,化疗药物是一类专门针对快速分裂细胞的细胞毒性药物,可抑制肿瘤细胞的增殖,并诱使其凋亡。但人体内骨髓造血干细胞等正常人体细胞亦可快速增殖,若细胞毒性化疗损伤骨髓造血干细胞,则会导致患者出现多系骨髓抑制[9]。有数据显示,80%以上的化疗药物能导致骨髓抑制,根据中国抗癌协会和临床肿瘤学会的专家共识,化疗后骨髓抑制这一概念可以分为化疗所致中性粒细胞减少(CIN)[10]、化疗所致血小板减少症(CIT)[11]和化疗相关贫血(CRA)[12]。
针对CIN、CIT以及CRA,临床上亦分别有不同的治疗手段,针对CIN可使用粒细胞集落刺激因子(G-CSF)进行治疗;针对CIT可使用促血小板生成药物重组人血小板生成素(rhTPO)、重组人白介素-11(rhIL-11)或血小板输注进行治疗;针对CRA可通过补充铁剂、叶酸、维生素B12、促红细胞生成素(EPO)以及输血进行治疗[13]。但是,针对CIM目前临床所采用的治疗方法,虽可在短期内取得一定疗效,但仍存在部分患者治疗效果不够理想并会出现一定毒副反应,以及便捷性较差等短板,进而影响了临床使用。此外,针对CIM的传统治疗,往往是在CIM发生后通过治疗干预缓解病情,无法真正做到“保护”骨髓目的。曲拉西利的出现为临床填补了这一空白。
此前,国外学者进行的三项随机、双盲Ⅱ期临床研究证明,在ES-SCLC患者在接受化疗前,给予曲拉西利可有效降低CIM的发生率,并减轻患者相关症状[13-15]。一项关于G1T28-02研究、G1T28-05研究以及G1T28-03研究的汇总分析[16]显示,曲拉西利能够显著降低化疗造成的血液毒性,并减少血液毒性相关药物管理以及由血液毒性导致的化疗药物减量,在增强了患者化疗耐受性同时,还可保证患者接受足量足疗程化疗。前不久,2022美国圣安东尼奥乳腺癌研讨会(SABCS)上的一项研究显示,曲拉西利或可提高患者体内CD8+T细胞与调节型T细胞比值,这与接受新辅助化疗的早期TNBC的OS以及病理完全缓解(pCR)率呈正相关[17]。而前不久落幕的2022年国际癌症免疫疗法学会(SITC)年会上报道的另外两篇关于曲拉西利的临床前研究也取得了相似结果[18,19]。本研究也证实了在化疗过程中使用曲拉西利可白细胞计数降低,患者各项血项指标维持在正常范围内。2022年美国临床肿瘤学会(ASCO)年会所报道的一项关于此三项研究的事后分析[20]显示,治疗前给予Trilaciclib可有效减少CIM事件的发生。值得关注的是,本研究曲拉西利的用药时间是在化疗进行一周期,患者已经出现骨髓抑制现象后,即第二周期开始使用的,可以看到曲拉西利依然能较好地发挥骨髓抑制保护作用,患者第二周期治疗后骨髓抑制现象得到明显改善,并持续作用在第三周期及第四周期过程中。
国内关于曲拉西利的研究已取得了一定的进展,由吉林省肿瘤医院程颖教授牵头开展的,曲拉西利中国首个注册临床关键性研究(TRACES)已达到主要研究终点,研究证明曲拉西利240 mg/m2在中国患者中具有良好的耐受性,ES-SCLC患者在化疗前给予曲拉西利可提高其对化疗的耐受性[21]。本研究的研究对象是老年患者,使用曲拉西利(400-430mg)三个周期,患者并未出现其他严重不良反应,体现了曲拉西利可提高老年患者对化疗的耐受性以及曲拉西利的用药安全性。
此前,曲拉西利曾获美国食品药品监督管理局(FDA)授予的突破性疗法认定和优先审评资格,并已于2021年2月获批上市。而在今年7月13日,曲拉西利亦已获得中国国家药品监督管理局(NMPA)批准在接受含铂类药物联合依托泊苷方案的广泛期小细胞肺癌患者中预防性使用,以降低化疗引起的骨髓抑制的发生率。同时,在《中国临床肿瘤学会(CSCO)小细胞肺癌诊疗指南2022》中,亦新增了关于曲拉西利作为一线及二线治疗化疗前应用的推荐(Ⅱ级推荐,2A类证据)。曲拉西利可保护骨髓造血干细胞祖细胞免受化疗药物的损伤,降低SCLC患者骨髓抑制发生率,改善患者对化疗的耐受性且不增加化疗安全风险,显示出多谱系骨髓保护的作用,这对于患者来说是全新的选择,也期待随着研究越来越深入,曲拉西利未来会给SCLC患者及其他肿瘤患者带来更多的福音!
专家简介
吴迪 教授
深圳市呼吸疾病研究所深圳市人民医院主任医师,医学博士,硕士研究生导师
深圳市人民医院呼吸与危重症医学科副主任
中华医学会呼吸病学分会肺癌学组委员
中国医师协会呼吸医师分会呼吸相关职业发展工作委员会委员
中国哮喘联盟网站编委
中国肺癌防治联盟肺癌免疫治疗委员会委员
国家临床研究中心-中国呼吸肿瘤协作组南区常委
广东省基层医药学会呼吸与危重症专委会副主任委员
广东省药学会呼吸用药专委会副主任委员
广东省基层医药学会肺癌专委会副主任委员
广东省胸部疾病学会肿瘤急危重症专业委员会副主任委员
广东省医学会呼吸病学分会肺癌学组副组长
深圳市医师协会呼吸医师分会副会长
深圳市医学会呼吸病专业委员会常委、肺癌学组组长
深圳市医师协会结核病学专委会副主任委员
参考文献:
[1]樊代明等.中国肿瘤整合诊治指南(CACA)小细胞肺癌[M].天津:天津科学技术出版社,2022:608-623.
[2]孙琦,李文倩,解友邦,等.化疗后骨髓抑制机制的研究进展[J].国际肿瘤学杂志,2023,50(1):33-36.
[3]王茂泽,陈山,陈亚红,等.老年肺癌化疗患者骨髓抑制发生及影响因素[J].中国老年学杂志,2021,41(10):2209-2212.
[4]Balducci L,Falandry C,List A, et al. Proactive Approachto Prevent Hematopoietic Exhaustion During Cancer Chemotherapyin Older Patients:Temporary Cell-CycleArrest[J]. Drugs Aging,2023,40(3):263-272.
[5]Chao Li,Benjamin Rich,Julie M. Bullock,et al. Population pharmacokinetics and exposure–response of trilaciclib in extensive-stages mall cell lung cancer and triple-negative breast cancer[J].BrJClinPharmacol,2023,89(3):1067-1079.
[6]李雪梅,熊艳丽,戴楠,等.不同化疗方案对广泛期小细胞肺癌的疗效分析[J].重庆医学,2023,52(6):861-866.
[7]宋晓凤,吕行,葛淑华,等.小细胞肺癌损伤分子机制研究进展[J].中国医药导报,2022,19(22):58-61.
[8]KaiqiJin,KaixuanZhang,FengZhou,etal. Selection of candidates for surgery as local therapy among early-stage small cell lung cancer patients: a population-based analysis[J].Cancer Commun (Lond). 2018 Mar 31;38(1):5.[9] Li C, Hart L, Owonikoko TK, et al. Trilaciclib dose selection: an integrated pharmacokinetic and pharmacodynamic analysis of preclinical data and Phase Ib/IIa studies in patients with extensive-stage small cell lung cancer[J]. Cancer Chemother Pharmacol. 2021, 87(5):689-700.
[10] 史艳侠,邢镨元,张俊,等.肿瘤化疗导致的中性粒细胞减少诊治专家共识(2019年版)[J].中国肿瘤临床, 2019, 46(17): 876-882.
[11] 中国临床肿瘤学会肿瘤化疗所致血小板减少症共识专家委员会. 肿瘤化疗所致血小板减少症诊疗中国专家共识(2018版) [J] . 中华肿瘤杂志,2018,40 (9): 714-720.
[12] 史艳侠,邢镨元,张俊,等.中国肿瘤化疗相关贫血诊治专家共识(2019年版)[J].中国肿瘤临床,2019,46(17):869-875.
[13] Weiss JM, Csoszi T, Maglakelidze M, et al. Myelopreservation with the CDK4/6 inhibitor trilaciclib in patients with small-cell lung cancer receiving first-line chemotherapy: a phase Ib/randomized phase II trial[J]. Ann Oncol. 2019,30(10):1613-1621.
[14] Daniel D, Kuchava V, Bondarenko I, et al. Trilaciclib prior to chemotherapy and atezolizumab in patients with newly diagnosed extensive-stage small cell lung cancer: A multicentre, randomised, double-blind, placebo-controlled Phase II trial [J]. Int J Cancer. 2020 ,148(10):2557–70.
[15] Hart LL, Ferrarotto R, Andric ZG, et al. Myelopreservation with Trilaciclib in Patients Receiving Topotecan for Small Cell Lung Cancer: Results from a Randomized, Double-Blind, Placebo-Controlled Phase II Study[J]. Adv Ther. 2021,38(1):350-365.
[16] Weiss J, Goldschmidt J, Andric Z, et al. Effects of Trilaciclib on Chemotherapy-Induced Myelosuppression and Patient-Reported Outcomes in Patients with Extensive-Stage Small Cell Lung Cancer: Pooled Results from Three Phase II Randomized, Double-Blind, Placebo-Controlled Studies[J]. Clin Lung Cancer. 2021, 22(5):449-460.
[17] Michanel Danso, Joyce O’Shaughnessy, Lisa Wang, et al. Trilaciclib Induces Immune Changes Within The Tumor Microenvironment In Early-Stage Triple-Negative Breast Cancer. 2022 SABCS, Poster #P3-06-03.
[18] Lu, ea al. Transient Inhibition of Cyclin-Dependent Kinase 4/6 With Trilaciclib Enhances Inhibitory Receptor Immunotherapy to Improve Antitumor Efficacy. 2022 SITC, Abstract 471.
[19]Ahn, et al. Trilaciclib, an Intravenous Cyclin-Dependent Kinase 4/6 Inhibitor, Enhances Antitumor Responses by Modulating T Cells. 2022 SITC, Abstract 1314.
[20] Jerome HG, et al. Impact of trilaciclib on multilineage chemotherapy-induced myelosuppression events in patients with extensive-stage small cell lung cancer: Post-hoc analyses of data from randomized clinical trials. 2022 ASCO,Abstract 8568.
[21] CHENG Y, et al. Myeloprotection with Trilaciclib in Chinese Patients with Extensive-Stage Small Cell Lung Cancer Receiving Standard Chemotherapy (TRACES). 2022 WCLC, Abstract EP08.02-078.
* 此文仅用于向医学人士提供科学信息,不代表本平台观点

