
背景介绍
腺癌和鳞癌是非小细胞肺癌的主要组织类型,约占全部原发性肺癌的80%左右,其次为小细胞癌。其他少见类型原发性肺癌包括:腺鳞癌,大细胞癌、涎腺来源的癌(腺样囊性癌、黏液表皮样癌等)等。在一项针对中国人群的大样本的原发性肺癌临床特征分析中显示,在我国肺鳞癌患者在男性患者中更为常见,因为此种类型的癌一般认为与吸烟有关[1]。
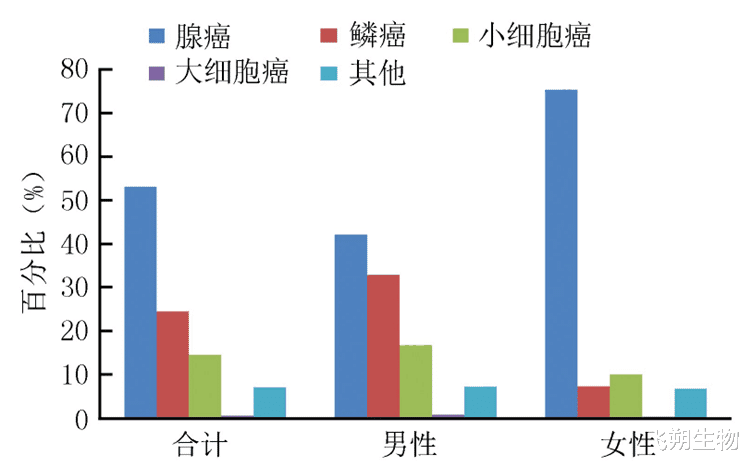
7075例不同性别肺癌患者的病理分型分布特点
肺鳞癌患者该做哪些检测?
2024版NCCN指南推荐所有肺鳞癌患者进行基因检测,包括EGFR、ALK、KRAS、ROS1、BRAF、NTRK1/2/3、MET 14号外显子跳跃突变、RET、ERBB2(HER2)以及PD-L1表达检测[2]。

2024版NCCN非小细胞肺癌诊疗指南
国内的2024版CSCO非小细胞肺癌诊疗指南推荐不可手术Ⅲ期和IV期的非小细胞肺癌患者在病理学诊断后保留足够组织标本进行分子检测,根据分子分型进行指导治疗;同时组织标本采用免疫组化法检测PD-L1表达(均为1类I级推荐)。另外,指南在Ⅱ级推荐中,单独对不吸烟、经小标本活检诊断鳞癌或混合腺癌成分的患者建议行上述基因突变检测(EGFR、BRAF V600、ALK、ROS1、RET、NTRK、MET 14外显子跳跃突变)。对比于23年的CSCO指南,24年CSCO指南新增,针对术后Ⅱ/Ⅲ期NSCLC患者进行PD-L1检测(I级推荐)和ALK融合检测(Ⅱ级推荐),指导辅助治疗[3]。


2024版CSCO非小细胞肺癌诊疗指南
肺鳞癌靶向治疗选择
肺鳞癌基因突变频率各家报道不太一样,但晚期肺鳞癌基因突变的总体概率约为10%左右,检出的主要靶点为EGFR,ALK,ROS1,BRAF以及c-Met扩增或者Met 14号外显子跳跃突变等,检出率分别为2.8%,1.3%,1.5%以及5.1%。虽然总体检出率只有约10%左右,但是考虑到晚期肺鳞癌在非小细胞肺癌中占比近40%,同时缺乏有效的治疗手段,基因检测可以带来更多的可能性。
由于基因突变存在着所谓的“高发人群”,比如EGFR 19del或者21号外显子L858R突变常见于亚洲、女性、不吸烟的肺腺癌;另外,ALK融合也常见于年轻不吸烟的女性患者;所以在肺鳞癌中也存在着一些基因突变的“高发人群”,比如在混合病理类型的肺鳞癌中基因突变检出率可达16%。
此外对一些小标本的肺鳞癌行多基因检测时发现至少有一个靶点的肺鳞癌(比如EGFR,Met 14号外显子跳跃突变等)的比例高达38%,其中在不吸烟的患者中比例高达47%[4-7]。
4项关于EGFR-TKIs抑制剂对EGFR突变的非腺癌患者疗效的研究:与EGFR敏感突变的肺腺癌比较,TKIs对EGFR突变肺鳞癌患者的疗效较差,有效率为26.7%~38.0%,中位PFS为3.1~3.98个月,值得肯定的是,肺鳞癌EGFR突变型的总反应率明显高于野生型,分别为25%和9.1%。
LUX-Lung8研究结果提示:阿法替尼组对比厄洛替尼组的疾病控制率、无疾病进展生存时间、总生存时间分别为51%vs40%、2.6个月vs1.9个月、7.9个月vs6.8个月。因为这项研究结果,美国FDA批准阿法替尼于晚期肺鳞癌的二线治疗,我国NMPA也批准了阿法替尼用于晚期肺鳞癌的二线治疗。国内的CSCO指南也在注释中表明驱动基因阳性的鳞癌参照非鳞癌,但在晚期肺鳞癌的治疗中,化疗仍是基石,针对鳞癌的靶向治疗仍还艰难的探索中。
肺鳞癌免疫治疗选择
驱动基因阴性的Ⅳ期肺鳞癌的一线经典治疗方案是含铂双药化疗,但是免疫治疗在肺鳞癌中取得了显著的疗效,因此除了化疗外,PD-1/PD-L1抑制剂免疫治疗已经成为晚期肺鳞癌的一线标准治疗方案。基于多项研究,2024年CSCO指南推荐推荐驱动基因阴性的晚期鳞癌的一线治疗为帕博利珠单抗单药、阿替利珠单抗单药或者是免疫联合化疗。
IMpower110结果显示,对比化疗,阿替利珠单抗显著改善PD-L1高表达(TC≥50%或IC≥10%)的野生型IV期非鳞或鳞状NSCLC患者的PFS(HR=0.63)和OS(HR=0.59)。KEYNOTE-024研究纳入了305例PD-L1 TPS≥50%且EGFR/ALK野生型晚期NSCLC(包括腺癌和鳞癌)患者,帕博利珠单抗较化疗显著延长PFS(HR=0.50)和OS(HR=0.63),且不良反应发生率低于化疗组。KEYNOTE-042研究进一步将人组标准扩大至PD-L1 TPS≥1%,结果提示与化疗相比,帕博利珠单抗显著降低死亡风险19%,但亚组分析提示主要获益人群为PD-L1 TPS≥50%的患者[8]。
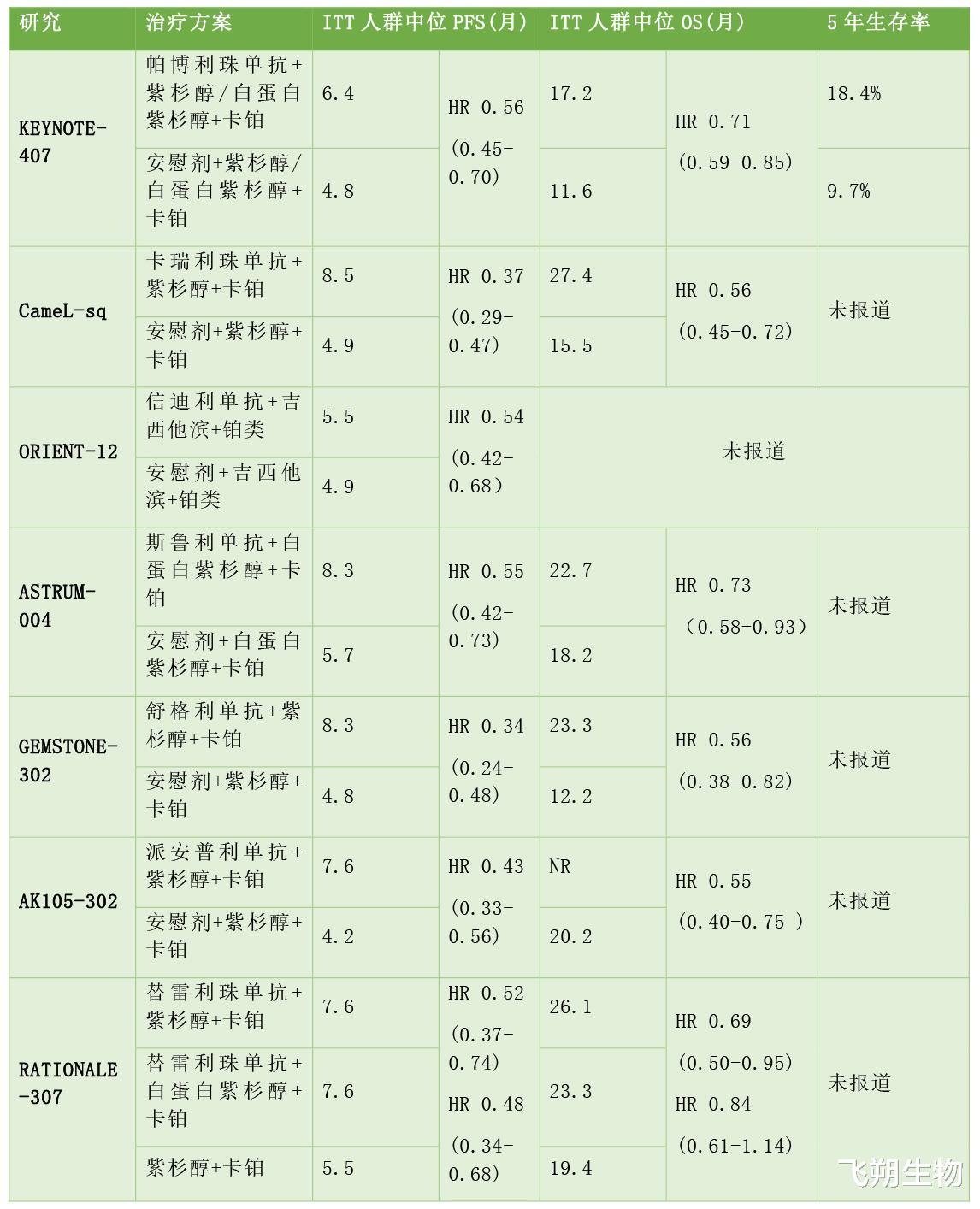
IV期鳞状非小细胞肺癌一线免疫联合化疗Ⅲ期研究生存数据汇总。
尽管免疫治疗在肺鳞癌中的响应率远比传统化疗方案高,改变了肺鳞癌一二线的治疗策略。然而,针对未经筛选的肺鳞癌患者,PD-1/PD-L1抑制剂的有效率仍较低,CheckMate-017试验中,未经筛选的肺鳞癌使用纳武利尤单抗(O药)治疗,有效率约为20%。因此如何选择免疫治疗标志物对于肺鳞癌的免疫治疗选择有着至关重要的作用。
总结
肺鳞癌的驱动基因图谱与肺腺癌存在差异,且肺癌已获批获批的靶点主要集中在肺腺癌,但是仍有8%-10%肺鳞癌存在驱动基因突变,约30%中国女性肺鳞癌患者为EGFR突变阳性[9],近60%的肺鳞癌患者为PD-L1组织表达阳性[10],这部分肺鳞癌患者进行基因检测或PD-L1组织表达检测,可有机会获得更多治疗方案的选择。指南也提及晚期的患者,无论肺腺癌还是肺鳞癌均推荐做基因检测。因此,肺鳞癌患者进行基因检测具有重要的临床价值,可更好的辅助临床制定治疗方案。
参考文献
[1] 杨军, 李贺, 郑荣寿, 等. 8081例原发性肺癌临床特征分析[J]. 中华肿瘤杂志, 2019, 41(6):471-476.
[2] NCCN非小细胞肺癌诊疗指南 2024.V7
[3] CSCO非小细胞肺癌诊疗指南 2024
[4] Sands JM, Nguyen T, Shivdasani P, Sacher AG, Cheng ML, Alden RS, Jänne PA, Kuo FC, Oxnard GR, Sholl LM. Next-generation sequencing informs diagnosis and identifies unexpected therapeutic targets in lung squamous cell carcinomas. Lung Cancer. 2020 Feb;140:35-41. doi: 10.1016/j.lungcan.2019.12.005. Epub 2019 Dec 16.
[5] Byeon S, Lee B, Park WY, Choi YL, Jung HA, Sun JM, Ahn JS, Ahn MJ, Park K, Lee SH. Benefit of Targeted DNA Sequencing in Advanced Non-Small-Cell Lung Cancer Patients Without EGFR and ALK Alterations on Conventional Tests. Clin Lung Cancer. 2020 May;21(3):e182-e190. doi: 10.1016/j.cllc.2019.11.006. Epub 2019 Nov 21.
[6] Zugazagoitia J, Ramos I, Trigo JM, Palka M, Gómez-Rueda A, Jantus-Lewintre E, Camps C, Isla D, Iranzo P, Ponce-Aix S, García-Campelo R, Provencio M, Franco F, Bernabé R, Juan-Vidal O, Felip E, de Castro J, Sanchez-Torres JM, Faul I, Lanman RB, Garrido P, Paz-Ares L. Clinical utility of plasma-based digital next-generation sequencing in patients with advance-stage lung adenocarcinomas with insufficient tumor samples for tissue genotyping. Ann Oncol. 2019 Feb 1;30(2):290-296. doi: 10.1093/annonc/mdy512.
[7] Lam VK, Tran HT, Banks KC, Lanman RB, Rinsurongkawong W, Peled N, Lewis J, Lee JJ, Roth J, Roarty EB, Swisher S, Talasaz A, Futreal PA, Papadimitrakopoulou V, Heymach JV, Zhang J. Targeted Tissue and Cell-Free Tumor DNA Sequencing of Advanced Lung Squamous-Cell Carcinoma Reveals Clinically Significant Prevalence of Actionable Alterations. Clin Lung Cancer. 2019 Jan;20(1):30-36.e3. doi: 10.1016/j.cllc.2018.08.020. Epub 2018 Sep 5.
[8] Mok TSK, Wu YL, Kudaba I, Kowalski DM, Cho BC, Turna HZ, Castro G Jr, Srimuninnimit V, Laktionov KK, Bondarenko I, Kubota K, Lubiniecki GM, Zhang J, Kush D, Lopes G; KEYNOTE-042 Investigators. Pembrolizumab versus chemotherapy for previously untreated, PD-L1-expressing, locally advanced or metastatic non-small-cell lung cancer (KEYNOTE-042): a randomised, open-label, controlled, phase 3 trial. Lancet. 2019 May 4;393(10183):1819-1830. doi: 10.1016/S0140-6736(18)32409-7. Epub 2019 Apr 4.
[9] Chang Q, Qiang H, Qian J, Lei Y, Lu J, Feng H, Zhao Y, Han B, Zhang Y, Chu T. Epidermal Growth Factor Receptor Mutation Status and Response to Tyrosine Kinase Inhibitors in Advanced Chinese Female Lung Squamous Cell Carcinoma: A Retrospective Study. Front Oncol. 2021 Apr 2;11:652560. doi: 10.3389/fonc.2021.652560.
[10] Yang X, Jiang L, Jin Y, Li P, Hou Y, Yun J, Wu C, Sun W, Fan X, Kuang D, Wang W, Ni J, Mao A, Tang W, Liu Z, Wang J, Xiao S, Li Y, Lin D. PD-L1 Expression in Chinese Patients with Advanced Non-Small Cell Lung Cancer (NSCLC): A Multi-Center Retrospective Observational Study. J Cancer. 2021 Oct 28;12(24):7390-7398. doi: 10.7150/jca.63003.
声明:本文仅用于分享,如涉及版权等问题,请尽快联系我们,我们第一时间更正,谢谢!
