
目前,我国医疗器械行业已经正式进入UDI实施阶段。嘉华顾问团队梳理了近两年UDI实操中遇到的企业常见常问问题,包括UDI基础知识、UDI数据库操作相关问题、UDI合规实施操作等内容,将通过【UDI快问快答】专题陆续分享给大家,希望对企业实施UDI和学习UDI相关知识有所帮助,请大家持续关注!欢迎与我们一起探讨交流,一起涨知识!
Q1请问国内DI的发码机构是GS1,那么这个DI可以直接用于欧盟和美国吗?
答:GS1是欧盟美国UDI发码机构,满足目前全球已发布的UDI相关要求,同一产品具体DI是否可以直接用,取决于企业自身管理的需要及产品包装语言是否有变化等因素。详见医疗产品GTIN分配原则:https://www.gs1.org/1/gtinrules/en/healthcare
Q2注册人/备案人可采用什么方式填报数据?
答:注册人/备案人可采用网页填报、数据模板导入和数据接口交换三种方式填报。(YY/T 1752-2020医疗器械唯一标识数据库填报指南)
采用网页填报请注意:唯一标识数据库支持网页单个填报,同时提供对已填报标识记录的“复制”功能。点击标识记录“复制”按钮后,将弹出新的标识填报页面,在此页面中除“最小销售单元产品标识”、“产品标识体系编码名称”、“包装标识信息”字段为空外,其他信息与被复制标识记录一致,此功能可减少网页填报工作量。
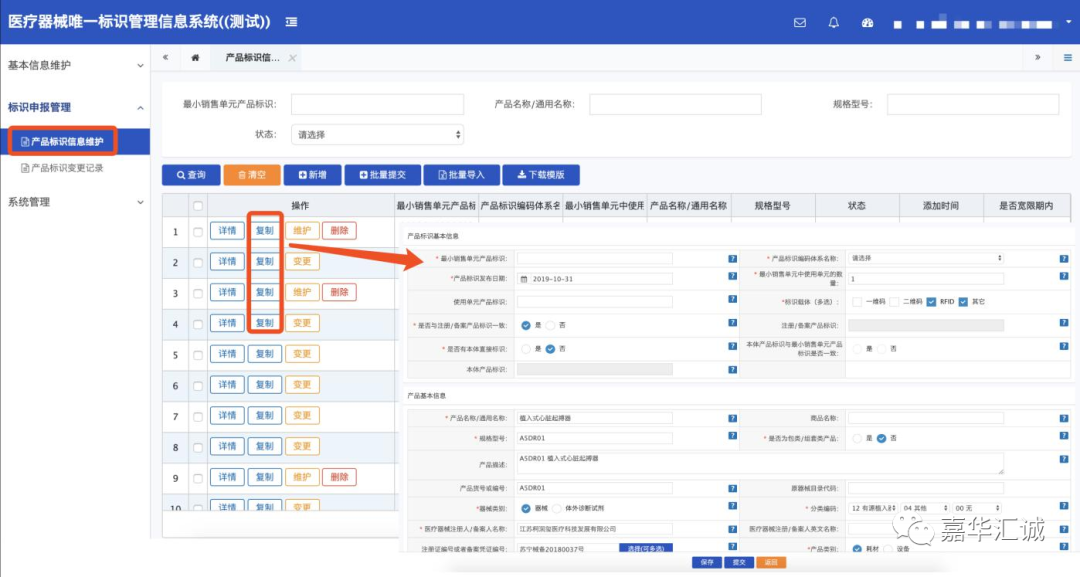
进行网页填报时需要一次性填完所有必填字段,才可成功提交,提交后标识信息将以未发布状态保存在系统中。保存则只需要维护“最小销售单元产品标识”、“产品标识体系编码名称”字段,成功保存后以草稿状态保存在系统中。
Q3如何选择医疗器械唯一标识数据载体?
1.相关法规要求
《医疗器械唯一标识系统规则》第十一条医疗器械唯一标识数据载体应当满足自动识别和数据采集技术以及人工识读的要求。如空间有限或者使用受限,应当优先采用符合自动识别和数据采集技术的载体形式。
自动识别和数据采集技术包括一维码、二维码或者射频标签等形式,鼓励采用先进的自动识别和数据采集技术。
采用一维码时,可将产品标识和生产标识串联,也可多行并联;采用射频标签时,应当同时具备一维码或者二维码。
2.基本概念说明
对于数据载体、一维码、二维码、射频标签,补充说明如下,供大家参考:
(1)数据载体,是指用机器可读的格式来表示数据的方法,用于对单元数据串的自动识读。
(2)一维码又称一维条码,是一种条码符号,在一维空间中使用条、空进行编码。常用的一维码的码制包括:EAN码、39码、交叉25码、UPC码、128码、93码,ISBN码,及Codabar(库德巴码)等。一维条码制作简单,自动识读设备成本较低,但破损纠错能力有限。
(3)二维码又称二维条码,光学可识读符号,需要在水平方向和垂直方向识读全部信息。二维条码符号有两种类型:矩阵式以及行排式。二维符号具有检错与纠错特性(参考ISO/IEC16022)。
二维条码能在很小的面积内表达大量的信息,它比一维条码能存更多的信息,也能表示更多的数据类型。因此,载体选择时,在医疗器械本体或包装/标签尺寸受限的时候能发挥更好的作用,但对自动识读设备的要求相较于一维条码要高。
(4)射频标签,一般指射频识别技术(Radio Frequency Identification,RFID),通过无线射频方式进行非接触双向数据通信,利用无线射频方式对记录媒体(电子标签或射频卡)进行读写,从而达到识别目标和数据交换的目的。
射频识别技术依据其标签的供电方式可分为三类,即无源RFID,有源RFID,与半有源RFID。
射频识别技术在更新资料、存储信息量、使用寿命、工作效率、安全性等方面较传统条形码技术更高,但选择射频标签作为载体,其赋予成本和自动识读设备配置成本相较于一维码和二维码要高。

3.嘉华建议
UDI载体选择建议遵循如下原则:
1.优先遵循监管部门的要求进行选择;
2.按照发码机构的标准和规范进行选择;
3.满足使用单位采集和记录的要求;
4.满足供应链各环节能够使用自动识别设备完成UDI信息自动采集和记录的要求;
5.考虑医疗器械本体或标签或包装表面能够标识UDI数据载体可使用的面积,选择合适的载体;
6.对于医疗器械更高级别的包装或标签赋予唯一标识数据载体,建议选择一维码与二维码结合的形式。
