DNase RNase检测背景
随着 mRNA 合成技术的应用越来越广泛,生物制品研究和工艺过程中的质量控制要求也在不断提高,这其中存在大量脱氧核糖核酸酶(DNases)和核糖核酸酶(RNases)残留和污染的可能性,包括生物样品中含有的内源性 DNase/RNase,存在于水、缓冲液、耗材表面,以及环境微生物和人来源的外源性 DNase/RNase。
此外,部分生物制品生产过程中会额外使用 DNase/RNase 去除宿主 DNA、RNA 的残留,因而有很大可能造成 DNase/RNase 的残留。残留 DNase/RNase 作为杂质,如果跟随生物制品进入人体内,有可能引发高强度的免疫原性等反应,引起较严重的安全性风险。因此对 DNase/RNase 的残留进行准确的分析检测,使之控制在安全范围内,成为生物制品生产质控的关注点之一。
DNase RNase检测方法进展
传统的核酸酶检测方法有比色法和凝胶电泳法。前者是基于 Kunitz 等的技术[1] 。在该技术中,向被测样本中加入 DNA/RNA 样本,通过紫外分光光度计检测 DNA/RNA 在特定波长下吸光度的变化,从而计算出样本中 DNase 或 RNase 的浓度。后者则是将检测吸光度的方式换成琼脂糖凝胶电泳,通过比较待测样本、阴性对照和阳性对照的条带明暗来确定是否存在 DNA/RNA 降解,从而定性判断待测样本中是否存在 DNase/RNase 残留。
后续在上述方法的基础上进行了改进,如 Hillier 等[2] 利用二茂铁的电化学活性,引入二茂铁基寡核苷酸,当 DNase 存在时,二茂铁被释放,产生电流变化,从而与 DNase 活性对应。此外还有高效液相色谱分析法、放射性底物分析法。Witmer 等[3] 合成了特殊的核糖核酸酶底物 U-3’-BCIP,该底物在 RNase 的作用下会释放一种报告基团,利用分光光度计在 650nm 条件下检测报告基团的释放情况,从而计算样本中 RNase 的活性和含量。
此外还有高效液相色谱分析法、放射性底物分析法、电化学法。
虽然高效液相色谱分析法和电化学法等方法可以达到较低的检出限,灵敏度较高,但受限于仪器设备,不适用于大量的研究实验和生产过程检测,因此目前最常用的仍是核酸水解凝胶电泳法和紫外分光光度计法。
然而核酸水解凝胶电泳法受实验人员的主观判断影响较大,无法准确定量,且操作时间长,测定通量较低。核酸水解紫外分光光度法定量限仅为 0.01U/μL,不适合微量核酸酶残留的活性检测。相比之下,荧光探针法灵敏度高、检测速度快且能实现核酸酶活性的定量检测,是生物制品的研发及生产过程中 DNase/RNase 残留活性检测的最佳选择之一。
DNase RNase检测相关法规
《中华人民共和国药典 2020 年版》中就《人用疫苗总论》、《人用重组单克隆抗体制品总论》、《人用基因治疗制品总论》及《细胞治疗产品研究与评价技术指导原则》分别提到了在该类型生物制品的研发及生产过程中需要对工艺中核糖核酸酶的残留相关杂质进行控制。
2023 年 4 月,为进一步提升《中国药典》生物制品标准的科学性,更好地保障生物制品质量,国家药典委员会设立了核酸酶残留量检测方法研究的课题,并在《关于征求核酸酶残留量检测方法验证意见的函》中提出了核酸酶残留量测定法(核酸荧光底物法)的草案。虽然目前暂没有相关标准中明确规定核酸酶残留量及其检测方法,但核酸荧光底物法在海外已用于检测分子生物学环境及试剂中核酸酶残留量, 如日本 WAKO 公司分子级别的无核酸酶化学品采用该方法作为质量认证的标准之一[4] , 德国Sartorius也将该方法作为无核酸酶耗材的质量认证标准[5] 。
荧光探针法检测DNase和RNase的原理与应用
基于核酸荧光底物法的 DNase 和 RNase 检测技术检测原理基本相同:设计出标记有荧光基团的 DNA 探针和 RNA 探针,与测试样本混合。
当样本中不含 DNases 或 RNases 活性时,该探针稳定存在,荧光基团和淬灭基团距离较近,由于荧光共振能量转移原理,不会产生荧光信号;
当样本中含有 DNases 或 RNases 活性时,探针被降解,荧光基团和淬灭基团相互远离,从而产生逐渐增强的荧光信号;
荧光增加的速率与酶的数量和活性成正相关。
原理如下图所示:

图1 荧光探针法原理示意图
目前,基于核酸荧光底物法的 DNase 和 RNase 检测技术已在多种场合被应用。Kyung 等[6] 利用荧光标记的 DNA 探针,检测金黄色葡萄球菌和大肠杆菌等常用的致病细菌;Janina 等[7] 利用该方法研究了金黄色葡萄球菌细胞外粘附蛋白与 DNA 的结合能力;Marie 等[8] 利用该方法对新型材料中的 DNase 涂层进行了表征;深圳先进技术研究院[9] 则提出可以利用荧光 DNA 探针实时监测纳米药物载体在体内的传递和代谢过程。Mommaerts 等[10] 利用该技术研究 RNA 提取过程中的影响因素;Savinova 等[11] 利用该方法对 Cas13a 蛋白的 RNase 活性进行了表征和测定;Bender 等[12] 使用该方法作为血液中 RNase 活性残留检测的工具,筛选了可以快速灭活内源性血液 RNase 的物质;Tong C[13] 等还将该技术与石墨烯结合,用于筛选 RNase A 的靶向药物。
瀚海新酶DNase检测试剂盒和RNase检测试剂盒
瀚海新酶自主设计研发了基于核酸荧光底物法的 DNase 检测试剂盒和 RNase 检测试剂盒。

图2 试剂盒产品图
该试剂盒经过特别的序列设计,探针可以分别识别多种 DNase 和 RNase,满足多种场景多种样本的检测需求。
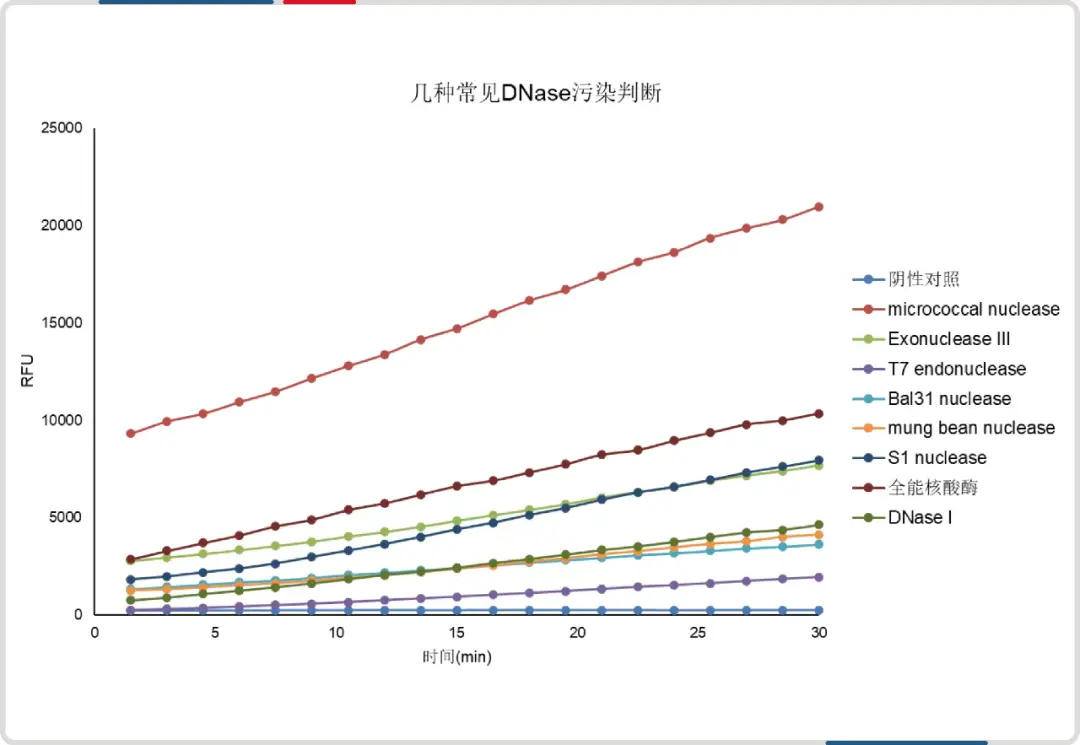

图3 常见种类的DNase/RNase检测
与某进口品牌(荧光探针法)相比,DNase 和 RNase 检测试剂盒最低检出限均低至其 1/8。

图4 DNase检出限测定,依据T品牌判断标准与空白信号比值大于2为有污染,其DNase检出限约1x10-5U/μL而瀚海检出限约为1.25x10-6U/μL

图5 RNase检出限测定,依据T品牌判断标准与空白信号比值大于2为有污染,其RNase检出限约2.5pg/mL,而瀚海检出限约为0.3125pg/mL
同时,试剂盒已经过完整的方法学验证,质量控制具有保障。

表1 瀚海DNase检测试剂盒技术指标

表2 瀚海RNase检测试剂盒技术指标
测试分子实验中常用的缓冲液或物料,瀚海试剂盒干扰物种类更少。

表3 瀚海试剂盒和T品牌试剂盒对常见样本的抗干扰性能对比
针对部分有干扰物质的样本,可结合实际使用场景,用水稀释后测试。


图6 酶液中含较高浓度的甘油造成假阳性,依据实际使用浓度,稀释40倍后测试,污染情况与前期电泳结果一致。
●产品特点:
• 满足多种场景、多种样本的检测需求:探针序列经过特别设计,识别多种 DNase 和 RNase,适用于生物制品、无核酸酶耗材、无酶试剂等样本检测;
• 灵敏度更高、抗干扰性能更强;
• 试剂盒经过完整的方法学验证;
• 质量稳定,长期供应:批内 CV<10%,批间 CV<15%。
● 真实样本测试案例:
将生物制品研发及生产过程相关的耗材、试剂等作为待测样本,进行测试。
•1.一次性无酶多层共挤袋
向多层共挤袋中加入无 DNase 无 RNase 的水,体积为袋标识量的 1/10,盖上盖子,颠倒 20 次,取出水作为待测样本,使用该技术进行定性测试,结果为 3 批次 60 个样本均无 DNase 残留。
•2.不同纯化阶段的蛋白酶K
待测样本分别取自不同纯化阶段,使用该技术进行定性测试,6 个样本测试结果与前期凝胶电泳法结果一致。

表3 不同纯化阶段的酶样本与凝胶电泳法结果比较
•3.核苷酸样本
将 ATP、GTP 用无 DNase 无 RNase 的水稀释至实验常用浓度后作为待测样本,进行加标回收率实验,结果均在 70%~130% 内。

表4 不同核苷酸底物加标实验结果
●产品规格与货号:

