01dsRNA是mRNA原液质量控制的关键必检项
mRNA疫苗是一种利用信使RNA(mRNA)的分子副本来产生免疫反应的疫苗。mRNA疫苗是由脂质纳米颗粒及封装在其中的RNA共同组成,保护RNA链并帮助其吸收进入细胞。因新冠疫情,在疗效、研发速度周期、成本价格、生产的可拓展性和安全性等方面有显著优势的mRNA疫苗技术路线开始备受关注。mRNA原液的制备和转录是疫苗生产的关键步骤,mRNA的质量直接决定了疫苗的临床表现。CDE发布的《新型冠状病毒预防用mRNA疫苗药学研究技术指导原则》和《体内基因治疗产品药学研究与评价技术指导原则(试行)》均明确指出要控制mRNA相关杂质如5’非帽化RNA、双链RNA(dsRNA)、长链RNA、截短RNA等的含量。
其中,dsRNA的全称是double-stranded RNA,译为双链核糖核酸。在IVT的过程中,T7 RNA聚合酶可能以RNA或DNA(模板链与非模板连)为模板进行转录,形成不同类型的dsRNA副产物:①runoff转录本3’端通过互补序列反向折叠,以同一RNA分子(runoff转录本)为模板进行延伸(顺式)(图1A),或流产转录本与runoff转录本互补配对(反式)(图1B),形成dsRNA。②T7 RNA聚合酶结合在模板dsDNA的5’端和3’端,依赖启动子转录生成正义链run-off转录本,同时可不依赖于启动子转录生成反义链RNA,二者结合形成dsRNA(图1C)[1]。

图1. IVT过程中dsRNA可能的形成机制
包裹mRNA的纳米脂质颗粒(LNP)通过胞吞与内体融合,在内体的酸性环境下,LNP裂解,释放出mRNA到细胞质中,游离的mRNA遇到核糖体,启动翻译。在内体中,mRNA中的dsRNA杂质被内体膜上的受体蛋白TLR3识别,激活后,TLR3启动信号转导途径,最终导致包括I型干扰素(IFN)在内的促炎性细胞因子分泌(图2)。而进入到细胞质中的dsRNA则主要被RIG-1和MDA5识别(图2),同样地,这两个效应器蛋白被激活后,会上调干扰素的表达[2]。TLR3、RIG-1和MDA5具有不同的RNA识别特异性,RIG-1主要监控dsRNA 5’末端,特别是末端的三磷酸基团(5’PPP),MDA5识别长 dsRNA,依赖的是双链长度(图3) [3],TLR3则可以识别短dsRNA,有研究表明,长度为40-45bp的dsRNA可有效激活TLR3[4]。dsRNA所表现出的免疫原性,一方面会因为自身免疫系统与翻译系统间的反馈调节而降低mRNA的翻译效率[5,6];另一方面,dsRNA使机体形成记忆免疫,当mRNA药物需要重复给药时,会造成药物效力降低[7]。因此,需要在mRNA疫苗药物的生产过程中严格控制dsRNA的含量,这就要求生产厂商能对dsRNA进行精准定量检测。

图2. 外源RNA激活细胞自身免疫反应的途径

图3. RIG-1和MDA5识别不同形式dsRNA
02ELISA法更适合用于dsRNA定量检测
dsRNA检测方法包括dot blot(免疫斑点)、ELISA(酶联免疫吸附实验)、HTRF(均相时间分辨荧光)和HPLC。USP《Analytical Procedures for mRNA Vaccine Quality(Draft Guidelines)》2nd Edition中推荐的dsRNA检测方法为dot blot和ELISA。 HPLC方法中,dsRNA的峰和主峰有时分不开,分辨率和准确度不够。Dot blot法中,首先将dsRNA标准品和待检mRNA样品滴在尼龙膜上,干燥、封闭后,加入检测抗体J2,孵育1hr后,洗去未结合检抗,再加入酶标二抗,同样孵育1hr后,洗去未结合酶标二抗,加入底物反应显色,通过mRNA样品与dsRNA标准品显色信号的比对来计算mRNA样品中dsRNA的含量[8],该方法操作简便,但是灵敏度不高。目前,开发成商用试剂盒的是ELISA法和HTRF法。HTRF结合了荧光共振能量转移FRET和时间分辨荧光TRF两种技术,该技术以Eu和d2分别标记两种抗体,当两种抗体因为与抗原结合而靠近时,Eu和d2之间发生荧光共振能量转移,产生检测信号。HTRF技术是Cisbio公司的技术专利,其开发的dsRNA检测试剂盒检测范围是1.56-100ng/mL,该试剂盒最大的优势是操作简便,仅需将两只抗体与待测样本混合,于4℃下静置一晚,即可进行检测,因此可将实验操作变异因素降至最低,检测稳定度和再现性高,但需要借助配有时间分辨模块的仪器进行检测。

图4. Dot blot法操作原理

图5. Cisbio公司病毒dsRNA检测试剂盒原理
ELISA是以体外抗原抗体反应为基础,将抗原抗体特异性反应与酶的高效催化作用相结合的一种检测方法,灵敏度可达(pg/mL)水平。它是目前商业应用最为成熟的免疫分析方法之一,在医学实验、临床诊断、生物制药方面的运用也极为广泛。双抗体夹心法,其基本原理是将定量的包被抗体以物理吸附的方法固定于微孔板表面,然后加入待检标本,通过加入检测抗体,酶标记第二抗体后用TMB底物显色,微孔板中颜色的深浅与待测物的浓度呈正相关。鉴于酶标二抗的局限性,现在厂家一般引入生物素亲和素系统(biotin avidin system,BAS),这种系统在提高反应灵敏度的同时,应用起来也更加方便。

图6. 双抗体夹心ELISA法偶联生物素亲和素系统检测原理
综合目前四种dsRNA检测策略(表1),开发同时兼具检测特异性、灵敏度和普适性的dsRNA ELISA检测试剂盒更能满足mRNA领域大规模生产与技术更新迭代的要求。

表1:目前dsRNA四种检测方法比较
03首款搭配四种修饰类型标准品的dsRNA ELISA定量检测试剂盒,稳定,准确,灵敏
dsRNA ELISA定量检测试剂盒开发过程中,因为没有dsRNA标准物质,标准品的制备、定量和选择是首要解决的问题。虽然有国外ELISA试剂盒选择使用polyI:C作为标准品,但抗体对polyI:C和dsRNA不同的识别响应[9]会导致dsRNA定量不准(图7)。因此,需要自主制备序列随机、高纯度(图9)、定量准确[10]的dsRNA标准品。
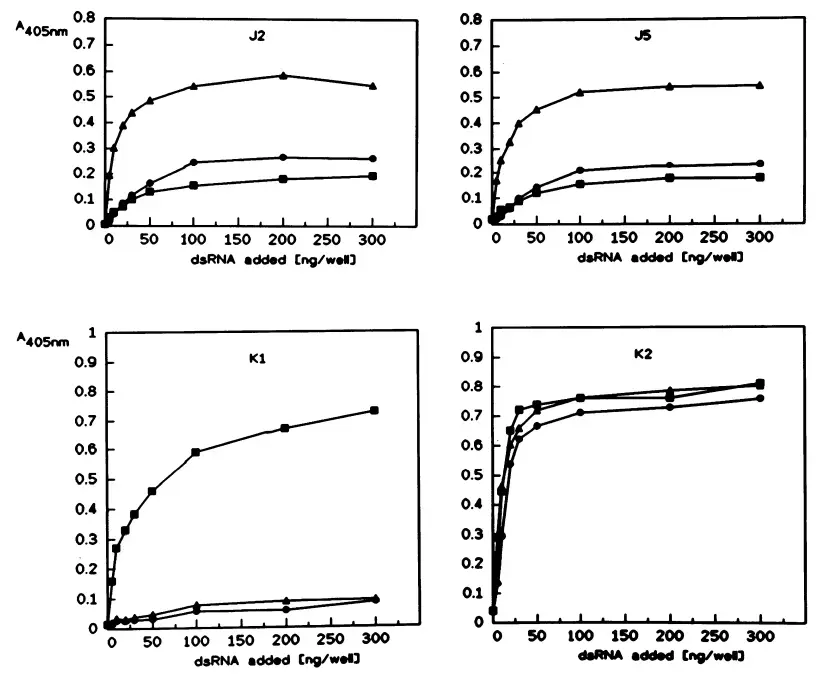
图7. ELISA实验验证不同dsRNA抗体对L-dsRNA((-▲-), poly(A) poly(U) (-●-) 和 poly(I) poly(C) (-■-) 的识别性[9]

图8. S1核酸酶和RNaseIII酶切验证HH dsRNA标准品(保证自制标准品确实为dsRNA)

图9. 琼脂糖凝胶电泳(左)和CE(右)验证HH dsRNA标准品纯度(保证dsRNA标准品纯度90%以上)
mRNA疫苗或药物的自免疫原性一方面来自于残留的dsRNA杂质,一方面来自于mRNA本身,因为机体会将mRNA视作外源入侵物质进行清除[11],这严重影响了mRNA的稳定性和效力,化学修饰核苷酸的引入可有效降低mRNA的自免疫原性[12],卡塔琳·考里科(左)和德鲁·韦斯曼(右)也因此获得了2023年诺贝尔生理医学奖。因为TLR7和TLR8结合在mRNA的GU-rich区域,所以修饰的尿嘧啶如pUTP、N1-Me-pUTP和5-OMe-UTP可以抑制PRRs(pattern recognition receptors)对mRNA的识别[13,14]。对于不同修饰类型dsRNA,抗体对识别也存在明显差异(图11)。为此,针对不同修饰类型dsRNA,搭配同种类别标准品更能保证准确定量。

图10. 2023年诺贝尔生理医学奖授予卡塔琳·考里科(左)和德鲁·韦斯曼(右)

图11. 抗体对对不同修饰类型dsRNA识别性
虽然,抗体对dsRNA的识别性一定程度上会受到序列碱基组成的影响[9],但通过抗体对筛选和浓度组合优化,可以尽量减少这一因素对测值的影响,保证测值基本不受dsRNA序列和长度的影响(图12)。

图12. 瀚海试剂盒对不同长度、序列dsRNA识别性

图13. 试剂盒特异性识别dsRNA

图14. 试剂盒标曲稳定性

图15. 试剂盒样本测值稳定性

图16. 试剂盒抗干扰性能
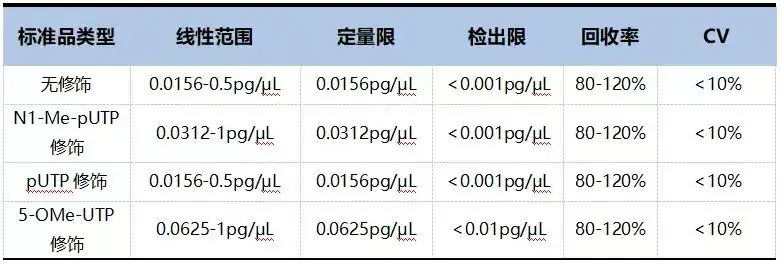
表2. 瀚海新酶dsRNA定量检测试剂盒(ELISA法)性能总结

