*仅供医学专业人士阅读参考


当前,帕金森病(PD)的治疗主要是多巴胺能替代疗法,可以缓解症状,但是并不能改善疾病的进展。
在寻找新疗法的过程中,有流行病学研究发现,2型糖尿病患者的PD风险显著增加[1],并且α-突触核蛋白、病理特征和胰岛素抵抗之间存在关联[2],此外,接受GLP-1受体激动剂或DPP-4抑制剂治疗的糖尿病患者相比其他治疗,PD风险也明显较低[3,4]。从机制上来看,GLP-1受体的激活对细胞因子介导的细胞凋亡具有保护作用,并可能刺激神经发生[5,6]。
基于这样的发现,法国图卢兹大学医院牵头的研究团队开展了一项2期双盲随机安慰剂对照临床试验,评估了一款GLP-1受体激动剂利司那肽对PD患者运动障碍进展的影响。试验结果显示,经过12个月的治疗,安慰剂组的运动障碍持续恶化,相比之下,利司那肽组没有发生显著进展,主要副作用为胃肠道副作用。
研究结果发表在《新英格兰医学杂志》上[7]。这是目前该研究领域内首个大规模多中心临床试验[8]。

这项名为LIXIPARK的临床试验从法国帕金森病和运动障碍临床研究网络(NS-Park–F-CRIN)包含的25个临床中心中选择了21个中心,招募了过去3年内确诊PD的40-75岁的患者,正在接受稳定的多巴胺能药物治疗,且没有运动并发症,以1:1的比例分配到利司那肽组或安慰剂组,接受12个月的治疗和2个月的洗脱期。
试验共招募了156名参与者,利司那肽组和安慰剂组各78名。利司那肽组有28名参与者(36%)在接受20μg/天的目标剂量时出现无法接受的副作用,将剂量降低至10μg/天,安慰剂组有3名(4%)降低剂量。两组分别有1名和3名参与者第12个月时的部分数据缺失。两组的依从性均>92.2%。
基线时,利司那肽组和安慰剂组的平均运动障碍协会-统一帕金森病评定量表(MDS-UPDRS)第III部分评分(范围:0-132,分数越高,运动障碍越严重)分别为14.8±7.3和15.5±7.8。
12个月时,利司那肽组的平均MDS-UPDRS第III部分评分为14.9,较基线下降了0.04,安慰剂组为18.8,较基线提高了3.04,两组间的差异为3.08。
14个月时,即经历过2个月的洗脱期后,非用药状态下,利司那肽组和安慰剂组的平均MDS-UPDRS第III部分评分分别为17.7和20.6。两组在6个月和12个月时的次要和探索性疗效指标的结果基本相似。
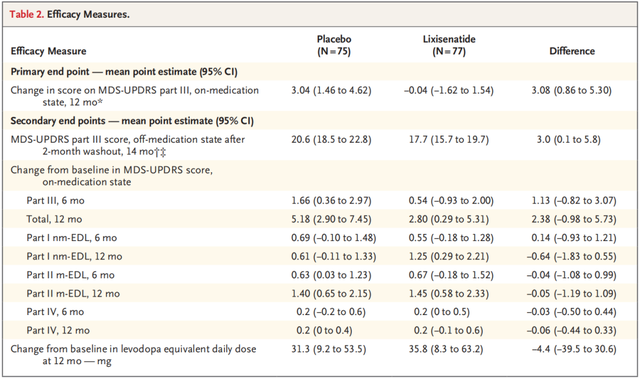
研究的主要终点和次要终点
安全性方面,利司那肽组和安慰剂组分别有86%和71%的参与者经历了至少一次不良事件(AE)。与安慰剂组相比,利司那肽组的胃肠道AE更常见,包括恶心(46% vs. 12%)、呕吐(13% vs. 3%)和胃食管返流(8% vs. 1%)。两组的严重AE发生率相似,各有5例,其中各有1例被认为与研究药物有关(利司那肽组为胰腺炎,安慰剂组为晕厥)。
利司那肽组报告了6例体重减轻AE,未在安慰剂组出现,但两组的平均体重未出现组间显著差异。安慰剂组报告了1例低血糖,未在利司那肽组出现。

参与者的AE汇总
综上,这项研究表明,与安慰剂相比,PD患者接受12个月的利司那肽治疗后,运动障碍进展能够得到抑制,但与更多的胃肠道副作用有关。
在《自然》的评论文章[8]中,未参与研究的阿拉巴马大学伯明翰分校的神经学家David Standaert表示,需要谨慎等待更长时间的观察结果,3分的评分差异是一个较小的变化,这种差异是否会随时间扩大?5年后是否会有15分的差异,还是仍然保持3分,如果是后者,那么可能“不太值得”。
研究人员也在等待一项大型临床试验的数据,试验评估了2年的艾塞那肽治疗对PD患者的影响,预计将在今年下半年公布。如果同样能够显示出疗效,无疑是个好消息,因为目前已经有了较新的GLP-1药物,相比开发于21世纪初期的利司那肽,可能能够带来副作用更少,或者更低剂量即可起效的治疗。
参考文献:
[1] Cullinane PW, de Pablo Fernandez E, König A, Outeiro TF, Jaunmuktane Z, War[1]ner TT. Type 2 diabetes and Parkinson’s disease: a focused review of current concepts. Mov Disord 2023;38:162-77.
[2] Bassil F, Delamarre A, Canron M-H, et al. Impaired brain insulin signalling in Parkinson’s disease. Neuropathol Appl Neurobiol 2022;48(1):e12760.
[3] Brauer R, Wei L, Ma T, et al. Diabetes medications and risk of Parkinson’s dis[1]ease: a cohort study of patients with diabetes. Brain 2020;143:3067-76.
[4] Svenningsson P, Wirdefeldt K, Yin L, et al. Reduced incidence of Parkinson’s disease after dipeptidyl peptidase-4 in[1]hibitors — a nationwide case-control study. Mov Disord 2016;31:1422-3.
[5] Bassil F, Fernagut P-O, Bezard E, Meissner WG. Insulin, IGF-1 and GLP-1 signaling in neurodegenerative disorders: targets for disease modification? Prog Neurobiol 2014;118:1-18.
[6] Yun SP, Kam T-I, Panicker N, et al. Block of A1 astrocyte conversion by microglia is neuroprotective in models of Parkinson’s disease. Nat Med 2018;24:931-8.
[7] https://www.nejm.org/doi/10.1056/NEJMoa2312323
[8] https://www.nature.com/articles/d41586-024-00974-0
本文作者丨应雨妍
