
子宫内膜癌(endometrial cancer,EC)是常见的女性生殖道恶性肿瘤,我国EC的发病率呈上升趋势。2022年估计我国新增病例84 520例,死亡病例17 543例[1]。1983年,Bokhman[2]根据EC的临床病理特征将其分为Ⅰ型(雌激素依赖型)和Ⅱ型(非雌激素依赖型)。随着肿瘤相关研究的迅速发展,EC的诊断和治疗已经不仅局限于传统的组织病理学领域,探索更精确的分子表达以实现精准治疗已经成为当前研究的热点。癌症基因组图谱(the cancer genome atlas,TCGA)EC分子分型已提出10余年[3],国内专家学者也越来越重视EC的分子分型[4-5],但其临床应用仍处于探索阶段。中国研究型医院学会妇产科学专业委员会组织国内妇科肿瘤学及病理学专家,根据相关文献和临床实践,讨论并制定了本共识,旨在指导EC分子分型在临床诊疗中的应用。
本共识推荐级别及其代表意义见表1。

1 中国EC患者主要分子特征
1.1 EC分子分型方法 TCGA子宫内膜癌分子分型整合了基因组学、转录组学、蛋白组学、基因拷贝数和甲基化数据,将EC分为POLE超突变型(POLE ultramutated,POLE mut)、微卫星高度不稳定型(microsatellite instability-high,MSI-H)、低拷贝数型(copy number low,CNL)、高拷贝数型(copy number high,CNH)4种亚型。由于此分子分型策略需整合多平台和多组学数据,在临床应用中较为复杂,故推广受一定局限。此后很多学者对EC分子分型进行了方法学简化及流程优化,提出了TransPORTEC[6]和ProMisE[7]分子分型策略,分别采用免疫组化(immunohistochemisty,IHC)、一代测序(sanger sequencing)和二代测序(next-generation sequencing,NGS)等技术进行检测,将EC分为POLE突变型、错配修复缺陷型(mismatch repair deficiency,MMRd)、无特定分子特征型(no specific molecular profile,NSMP)或p53野生型(p53wt)、p53异常型(p53abn)。其操作更简单,同时保证了与TCGA分子分型的一致性。
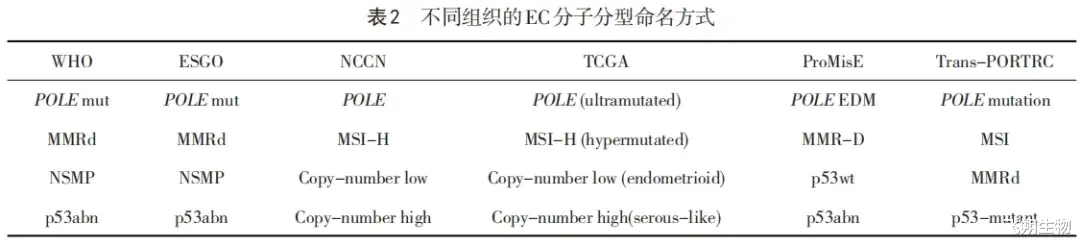
2020年,EC分子分型纳入了美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南[8]及世界卫生组织(World Health Organization,WHO)女性生殖器官肿瘤分类标准(第5版)[9],其中NCCN指南在改良方法的基础上沿用了TCGA的分型命名方法,而WHO指南借鉴了TransPORTEC和ProMisE分型命名方法。2023年,国际妇产科联盟(FIGO)EC新分期也将TCGA分子分型纳入EC管理中,建议所有EC患者进行分子分型,并在FIGO分期中添加下标“m”;FIGO Ⅰ期和Ⅱ期中分子分型为POLE mut者,分期调整为ⅠA期;p53abn者分期调整为ⅡC期,NSMP和MMRd者不调整分期,但可以在原FIGO分期添加下标以便资料收集;FIGO Ⅲ期和Ⅳ期病例分期不受分子分型影响,但也可以在原FIGO分期添加下标以便资料收集。FIGO 2023年分期综合了组织学及分子分型,以更准确地指导预后评估和治疗[10]。本共识在回顾文献时保留了各参考的原始命名方式,见表2,在叙述及建议部分统一使用WHO分子分型命名方式,采用的分期标准为FIGO2023年EC分期,便于阅读理解。
1.2 中国EC患者主要分子特征 目前,国内EC分子分型临床检测及应用仍处于起步阶段。2024年,北京大学人民医院公布了479例EC基于NGS及免疫组织化学方法的分子分型,包括POLE mut型28例(5.85%),MMRd型 67例(13.99%),p53abn型60例(12.53%),NSMP型324例(67.64%)[11]。由此可见,与已发表的关于高加索人群中EC分子亚型的研究结果相比,中国EC患者中NSMP的比例明显更高,具有区别于欧美人群的独特情况。因此,需在各层医院依据认可的不同检测方法及手段开展分子分型检测,进一步探索更精准地适合中国EC患者的诊疗方案。
推荐意见:建议所有确诊为EC的患者在有条件的情况下进行分子分型检测,检测手段及方法推荐参考2020年《WHO女性生殖器官肿瘤分类标准修订版》[9]《子宫内膜癌分子检测中国专家共识(2021年版)》[12](推荐级别:2A类)。MMRd型患者在知情同意情况下,建议行林奇综合征相关胚系基因突变检测,并提供遗传风险咨询、评估及随诊(推荐级别:2A类)。
2 EC分子分型指导保留生育功能治疗
随着EC发病的年轻化趋势,EC患者保留生育功能治疗问题日益凸显。ProMisE分型系统已证实在诊断性子宫内膜标本(活检或者刮宫)与全子宫标本中具有高度一致性[13-15]。分子分型对于判断育龄期患者能否进行保留生育功能治疗有重要参考价值,且分子特征有助于预测内分泌治疗疗效[16-18]。
2.1 POLE mut型 POLE mut型EC患者发病年龄较小,肿瘤常为高级别,存在明显的肿瘤浸润淋巴细胞(tumor-infiltrating lymphocytes,TILs),但具有良好的肿瘤预后[19]。因此,POLE mut型患者可能受益于保守治疗,对该型患者是否可以放宽保留生育功能治疗的适应证值得探究[20]。然而,有报道提示部分POLE mut型患者在常规孕激素方案治疗后出现疾病进展或复发[16],故对于该部分患者是否应用常规内分泌治疗手段有待更进一步研究。
推荐意见:POLE mut型患者预后较好,建议在严格评估、可充分去除病灶的情况下,进行保留生育功能治疗,治疗方案建议进行临床试验(推荐级别:2B类)。
2.2 MMRd型 MMRd型EC患者相较于MMR完整型(mismatch repair proficient,MMRp)患者,具有以下特征:体重指数(BMI)低,临床分期晚,分化级别高,深肌层浸润及淋巴脉管间隙浸润(lymphovascular space invasion,LVSI)比例高,以及总生存期(OS)和无进展生存期(PFS)短[16]。有报道提示,MMRd型的EC和子宫内膜不典型增生患者孕激素治疗的缓解率显著低于MMRp型[17]。2021年韩国发表了首个关于分子分型对EC患者保留生育功能预后影响的研究,发现MMRd型患者孕激素整体反应率、6个月疾病完全缓解率均显著低于p53wt患者[16]。且即使治疗完全缓解后,MMRd型患者的复发率也更高,推测原因可能为该型患者具有肿瘤高突变负荷(tumor burden mutation-high,TMB-H,≥10mutations/Mb),激活非孕激素受体依赖的分子通路,进而影响病灶对孕激素的应答[21]。目前,尚未见免疫及靶向治疗在MMRd型保留生育功能患者中应用疗效的报道。
有研究显示,林奇综合征女性患者对孕激素治疗可表现出子宫内膜应答[22],且有林奇综合征获得保守治疗后完全缓解并获得生育的个案报道[22-24]。NCCN指南并未将林奇综合征作为保留生育功能治疗的绝对禁忌证;但是,由于对应的MMRd型的孕激素治疗反应较差,需要充分告知孕激素治疗不敏感的可能,并在治疗过程中严密随访,要同时进行胃肠镜等其他系统筛查。林奇综合征女性患者的子代有50%的遗传风险,建议行胚胎植入前遗传学检测以阻断遗传。
推荐意见:MMRd型患者孕激素治疗反应较差,治疗后复发风险升高,不宜首选保留生育功能治疗(推荐级别:2A类)。若进行保留生育功能治疗,需综合个体化情况及需求,经多学科评估后慎重决定,建议开展免疫靶向治疗临床试验研究(推荐级别:2B类)。对于林奇综合征女性患者,如进行保留生育功能治疗,需要充分告知失败风险、患其他肿瘤风险、子代遗传风险等,在保留生育功能过程中应参照林奇综合征相关指南共识进行管理(推荐级别:2B类)。
2.3 NSMP型 NSMP型EC多为低级别、早分期,雌激素受体(ER)和孕激素受体(PR)高表达[13],对孕激素治疗反应较好。有研究发现,在50岁以下的年轻EC患者中,NSMP型患者年龄较其他类型患者更小,其生存期短于POLE突变组,高于MMRd及p53abn组[25]。但是并非所有NSMP型患者对孕激素反应均好,由于我国患者人群及保留生育功能患者多数为该分型,有必要进一步细化这一人群的亚型特征。对预后相关标志物的免疫组化分析显示,PR及ER阳性表达与NSMP型EC的预后良好相关,而L1细胞黏附分子(L1CAM)过表达与预后不良相关[26]。另外有研究表明,1q.32.1拷贝数扩增、DNA损伤与NSMP型EC患者预后更差相关[27-28]。以上分子标志物可能有助于该型EC进一步细化分层。
推荐意见:对NSMP型患者推荐行保留生育功能治疗,可联合病理学及分子特征进一步分层评估个体风险,并指导个体化治疗(推荐级别:2A类)。NSMP型患者尚缺乏分子特征,有必要进一步研究再分型(推荐级别:2A类)。
2.4 p53abn型 p53abn型的EC多为浆液性癌或透明细胞癌,具有较强的侵袭性,易发生LVSI、肌层浸润、远处转移[29],预后最差,原则上不应进行保留生育功能治疗[29-30]。IHC检测p53蛋白异常表达与孕激素抵抗有关,联合p53状态和Ki67表达水平或能独立预测EC患者治疗达缓解的时间[18]。由于通过IHC蛋白检测与基因检测不一致率达10%,故对于有保留生育功能需求而IHC考虑p53abn型患者,建议行基因检测以进一步明确分型。
推荐意见:对于免疫组化考虑p53abn型患者,建议行基因检测(二代测序)验证(推荐级别:2A类)。p53abn型患者预后较差,孕激素疗效不佳,不建议进行保留生育功能治疗(推荐级别:2A类)。
3 分子分型在早期EC患者手术路径选择中的应用
两项大规模随机对照临床试验证实,对于病灶局限于子宫体的EC,接受微创手术与开腹手术后患者的复发及生存情况差异无统计学意义[31-32],而微创手术相比开腹手术具有术中出血量低、围术期并发症发生率低以及患者住院时间较短的优势[33-34]。同时,基于多项随机对照试验的荟萃分析表明,微创与开腹手术在临床早期EC治疗中可带来相似的OS及无病生存期(DFS)[35]。基于以上证据,目前美国及欧洲EC诊治指南推荐对于病灶局限于子宫的EC患者首选微创途径进行全面分期手术[36-37]。但近期有回顾性研究提示,分子特征可能影响EC患者接受不同途径手术后的预后情况,对于POLE mut型及MSI-H型患者,接受微创手术与开腹手术后患者的生存情况差异无统计学意义;而对于p53abn型患者,微创手术组的PFS显著劣于开腹手术组[38-39]。对于NSMP型患者,尽管目前仍无明确研究证据提示手术途径对患者预后存在显著影响,但考虑其在我国人群中占比较高,内部可能存在一定异质性,仍需进一步研究探索新的用于患者分层的指标,以指导手术途径选择。另外,目前以上结论尚缺少相关前瞻性随机对照研究的进一步验证,故对其临床应用仍需慎重。
推荐意见:对于临床早期EC患者,有条件的地区可参考子宫内膜活检标本的分子分型结果进行术式选择,其中POLE mut型、MMRd型及NSMP型患者仍推荐行微创手术(包括腹腔镜手术及机器人辅助腹腔镜手术,推荐级别:1类)。对于p53abn型患者,由于缺乏相关临床证据,需向患者充分交代开腹与微创手术的利弊及微创手术可能带来的生存风险后,由医患双方共同协商决定所采用的手术途径(推荐级别:2B类)。
4 EC分子分型在辅助治疗中的应用
欧洲妇科肿瘤学会(European Society of Gynaecological Oncology,ESGO)/欧洲放射肿瘤学会(European SocieTy for Radiotherapy and Oncology,ESTRO)/欧洲病理学会(European Society of Pathology,ESP)于2021年联合发布了EC管理指南,将EC分子分型融入预后的分层管理[37],使后续辅助治疗方案的制定更为清晰有序。结合现有研究报道及相关指南推荐,本共识按各分子分型中不同危险因素及对应的风险分层进行总结,对术后辅助治疗推荐如下。
4.1 POLE mut型 在2021年ESGO/ESTRO/ESP子宫内膜癌管理指南中,FIGO2009Ⅰ~Ⅱ期的POLE mut型EC(无论病理类型、肿瘤分化级别、LVSI和肌层浸润状态)属于低危组(ⅠAm-POLE mut期)[10,37]。对PORTEC-1试验中观察组进行回顾性分析提示,POLE mut型EC10年无复发生存率明显高于POLE野生型,同时体外试验证实发生POLE突变的胚胎干细胞对放化疗敏感性均不高[19]。POLE mut型EC预后良好的机制尚不完全清楚,目前认为,POLE mut型肿瘤具有极高的突变负荷,能产生大量新抗原,且常伴有大量淋巴细胞浸润,所以肿瘤细胞诱发的活跃的肿瘤免疫应答可能是其中的原因之一;此外,POLE mut型EC肿瘤细胞浸润淋巴细胞存在程序性死亡受体1(PD-1)过表达,这使得该亚型成为免疫治疗的潜在获益人群[40-41]。另一方面,POLE mut型肿瘤细胞基因组中积累了大量乘客突变(passenger mutation),这些突变可能会破坏细胞的生理功能,甚至导致肿瘤细胞死亡,这是POLE mut型EC预后良好的另一可能原因[42]。对晚期、复发性POLE mut型EC的临床证据极为有限,亟需开展临床试验。
推荐意见:FIGO2023ⅠAm-POLE mut期EC患者无需辅助治疗(推荐级别:2A类)。无残留病灶的Ⅲ~Ⅳ期POLE mut型患者是否进行辅助治疗无数据支持,建议开展临床试验(推荐级别:2B类)。对于复发性、转移性、难治型POLE mut型癌患者,缺乏数据,基于其高突变负荷及PD-1过表达,二线治疗可考虑辅助应用靶向PD-1/程序性细胞死亡配体1(PD-L1)等分子的免疫检查点抑制剂(immune checkpoint inhibitors,ICI),建议开展临床试验(推荐级别:2B类)。
4.2 MMRd型 2021年ESGO/ESTRO/ESP指南结合FIGO2009分期及分子分型,将EC进行预后风险分层。(1)低危组:ⅠA期+低级别(G1~G2)内膜样癌+LVSI阴性/局灶阳性。(2)中危组:ⅠA期+高级别(G3)内膜样癌或ⅠB期+低级别(G1~G2)内膜样癌+LVSI阴性/局灶阳性。(3)中-高危组:Ⅰ期内膜样癌+LVSI弥漫阳性、ⅠB期+高级别(G3)内膜样癌及Ⅱ期内膜样癌。(4)高危组:Ⅲ~ⅣA期无残留病灶的内膜样癌或Ⅰ~ⅣA期无残留病灶但伴有肌层浸润的浆液性癌、未分化癌、癌肉瘤[37]。在MMRd型患者中,上述低危组大致对应FIGO2023分期中的ⅠAm-MMRd期,中危组对应ⅠB~ⅠCm-MMRd期,中-高危组对应ⅡA~ⅡBm-MMRd期;高危组对应ⅡC~ⅣAm-MMRd 期。2019年一项多中心回顾性研究分析了ⅠB~Ⅱ期高级别EC术后辅助放疗与预后的关系,发现MMRd型患者辅助放疗后DFS优于未治疗组,推荐以MMR状态作为预测放疗疗效的指标[43]。在对PORTEC-2的回顾性分析中,阴道近距离放疗和盆腔外照射对MMRd亚型患者的OS差异无统计学意义,提示中危组MMRd型EC更适合副反应更小的阴道近距离放疗[44]。PROTEC-3研究评估了具有高危因素的EC患者辅助放疗对比辅助放化疗的预后影响,结果显示在MMRd型中辅助放化疗与辅助放疗复发率及生存率差异无统计学意义[45]。此外,MMRd内部的异质性已引起重视。MMRd可大致分为启动子甲基化相关(主要为MLH1基因)和MMR基因突变相关两种遗传学机制,多项研究显示,MLH1启动子甲基化是影响疾病特异性生存的独立危险因素[46-49]。有研究表明,MLH1启动子甲基化相关的MMRd型EC对免疫治疗的反应较MMR基因突变相关的MMRd型患者差[50],但未见研究系统探索此2种MMRd亚型对放、化疗的敏感性。因此,未来对MMRd型EC的再分层及探索相应的辅助治疗策略具有重要意义。
MMRd型EC的另一特点是伴有大量的肿瘤新抗原及淋巴细胞的浸润,被认为是4种分子分型中免疫治疗的最大获益人群[41,47,51]。2018年NCCN指南推荐对复发性、高危型EC患者考虑进行肿瘤突变负荷(TMB)检测以用于指导免疫治疗。2019年,帕博丽珠单抗获NCCN指南推荐,成为MSI-H/MMRd复发、转移性和高危型EC系统治疗的有效方案[52]。纳武单抗(nivolumab)、多斯塔单抗(dostarlimab)、阿维单抗(avelumab)等药物也被相继证实在EC治疗中的有效性,在NCCN指南中推荐用于复发、转移性EC患者二线治疗[52-54]。
推荐意见:FIGO2023ⅠAm-MMRd 期患者无需进行辅助治疗(推荐级别:2A类)。FIGO2023ⅠB~ⅠCm-MMRd期患者推荐术后辅助阴道近距离放疗(推荐级别:2A类)。FIGO2023ⅡA~ⅡBm-MMRd期患者推荐术后辅助盆腔外照射放疗(推荐级别:2A类)。FIGO2023ⅡC~ⅣAm-MMRd 期推荐同步/序贯放化疗(推荐级别:2A类)。复发/转移性MMRd型患者的二线治疗推荐靶向PD-1/PD-L1的免疫治疗(推荐级别:2B类)。MMRd型患者推荐行MLH1启动子甲基化检测,MLH1启动子甲基化导致的MMRd型EC预后差,建议开展试验探索最佳的辅助治疗策略(推荐级别:2B类)。
4.3 NSMP型 根据2021年ESGO/ESTRO/ESP指南,早期的NSMP型EC与MMRd型危险分层一致。因此,对于初治NSMP型患者辅助放化疗可大致参照MMRd型患者进行风险分组并采取相应治疗。在晚期/高危病例方面,GOG-86P临床试验纳入了349例晚期或复发性EC患者,通过对比分析发现存在CTNNB1突变的患者在化疗同时接受贝伐(珠)单抗治疗后可获得更长的PFS[55]。一项大型Ⅲ期临床试验KEYNOTE-775/Study 309结果显示,与单纯化疗方案相比,帕博丽珠单抗与乐伐替尼联合治疗临床效果显著[56]。2022年NCCN指南推荐帕博丽珠单抗联合乐伐替尼作为复发、进展的非MMRd的EC患者的二线治疗[57]。近期,一项在中国人群中探讨信迪利单抗联合安罗替尼用于复发或晚期EC的疗效和安全性的Ⅱ期临床试验显示,接受信迪利单抗联合安罗替尼治疗的复发或晚期EC患者,客观缓解率和疾病控制率分别为73.9%和91.3%,提示ICI联合酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKI)在中国人群中有效[58]。
值得注意的是,在TCGA分子分型中,未被归入POLE mut、MMRd和p53abn型的EC均归入NSMP型。在组织病理学方面,NSMP型为一高度异质性群体,可表现为子宫内膜样癌、去分化/未分化癌、癌肉瘤、中肾样癌等,部分传统免疫组化标志物(如ER、PR等),为NSMP亚型的预后保护因素,而KRAS、ARID1A、CTNNB1的突变和L1CAM过表达等与不良预后有关。综合上述研究,对此类占我国EC人群70%的病例,临床工作中不可完全将其作为与MMRd型类似的同一种亚群对待,而是应该结合传统临床病理指标(如ER、PR)及特定分子的检测结果综合判断,探索个体化辅助治疗策略。推荐意见:早期NSMP型患者的辅助治疗参照MMRd型。复发/转移性NSMP型患者可加行CTNNB1基因检测。若该基因突变,化疗同时可考虑联合贝伐(珠)单抗(推荐级别:2B类)。复发/转移型MSS/MMRp型患者的二线治疗推荐ICI与TKI联合治疗(推荐级别:2B类)。
4.4 p53abn型 根据2021年ESGO/ESTRO/ESP指南,p53abn型自身即为高危因素。PROTEC-3研究提示,在p53abn患者中,辅助放化疗可提高患者5年无复发率和5年总生存率,证实p53abn型可获益于补充化疗[45]。HER2蛋白是具有酪氨酸蛋白激酶活性的跨膜蛋白,约30%的子宫浆液性癌患者HER2/Neu过表达,提示针对HER2的靶向药物的应用潜能。2018年一项Ⅱ期随机对照临床试验提示,对于HER2阳性的晚期或复发性子宫浆液性癌患者,使用卡铂+紫杉醇+曲妥珠单抗组合用药较单纯化疗组提高了患者的PFS。但2010年公布的另一项纳入28例HER2过表达的Ⅲ~Ⅳ期或复发性子宫浆液性癌患者的Ⅱ期临床试验提示,加用曲妥珠单抗治疗后未观察到明显的临床疗效,其中原因有待进一步研究。有研究发现46%的p53abn型EC具有同源重组缺陷(homologous recombination deficiency,HRD)的特点,RAINBO中的RED试验即是探讨在辅助治疗中加用尼拉帕利是否能改善p53abn型患者预后的研究。上述研究提示p53abn型EC可能是多腺苷二磷酸核糖聚合酶(PARP)抑制剂的潜在获益人群。
推荐意见:FIGOⅡCm-p53abn~Ⅳ期患者为高危组,推荐进行同步放化疗或序贯放化疗治疗(推荐级别:2A类)。推荐采用免疫组化联合荧光原位杂交(FISH)方法进行HER2/Neu过表达检测,若发生HER2过表达可尝试在化疗同时联合曲妥珠单抗治疗(推荐级别:2B类)。推荐进行HRD相关检测,若存在HRD,可尝试在辅助放化疗同时使用PARP抑制剂治疗(推荐级别:2B类)。而对于复发、进展的晚期肿瘤,无论分子分型类型如何,均需结合临床病理及分子学特点进行综合判断,可尝试进行化疗、放疗、激素、靶向、免疫或联合的多种探索性治疗[59-60]。如在晚期、复发性EC中可进行NTRK基因融合检测并使用拉罗替尼/恩曲替尼靶向药物作为二线治疗[57]。PARP抑制剂、抗PD-L1和贝伐(珠)单抗三联应用作为复发性EC的非化疗联合治疗方案也获得了临床安全及疗效的初步认证。此外,多种泛癌分子标志物(如PI3K/AKT/mTOR、FBXW7、PTEN基因等)突变及其相应靶向药物治疗EC的临床试验也在不断探索尝试,因其证据等级相对较低并缺乏分子分型相关特异性,在本共识中未进行总结和推荐。
5 结语
2021年《子宫内膜癌分子检测中国专家共识》对EC分子分型检测方法、林奇综合征遗传学筛查及分子靶向标志物检测等方面进行了全面综述及推荐。本共识在前期基础上综合了近期国内外文献、指南,侧重于对分子分型在我国EC临床中的应用与实践作出相应指导。需要说明的是,虽然目前已有部分前瞻性试验逐步开展,但结果仍未公布,部分推荐内容缺乏高质量的循证医学证据,并且结果存在一定争议。同时,目前临床使用阶段尚有很多空白领域和问题值得探讨:如分子分型如何指导手术范围的选择;基于分子分型结果应用的免疫、靶向药物能否作为保留生育功能或临床辅助治疗的一线推荐方案等。随着分子生物学技术的不断发展及前瞻性临床研究试验的开展,EC的精准诊疗有望得到进一步提升,本共识也将不断更新完善,以便于临床普及和应用。
参考文献
[1] Xia C,Dong X,Li H et al. Cancer statistics in China and United States,2022:profiles,trends,and determinants[J]. Chin Med J (Engl),2022,135(5):584-590.
[2] Bokhman JV. Two pathogenetic types of endometrial carcinoma[J]. Gynecol Oncol,1983,15(1):10-17.
[3] Cancer Genome Atlas Research Network,Kandoth C,Schultz N,et al. Integrated genomic characterization of endometrial carcinoma[J]. Nature,2013,497(7447):67-73.
[4] 李立伟,王建六. 子宫内膜癌诊疗已经进入分子时代[J]. 中国妇产科临床杂志,2024,25(2):97-98.
[5] 沈丹华,王建六. 重视子宫内膜癌分子分型的开展及应用[J]. 中华妇产科杂志,2023,58(10):729-732.
[6] Stelloo E,Bosse T,Nout RA,et al. Refining prognosis and identifying targetable pathways for high-risk endometrial cancer,a TransPORTEC initiative[J]. Mod Pathol,2015,28(6):836-844.
[7] Kommoss S,McConechy MK,Kommoss F,et al. Final validation of the ProMisE molecularifier for endometrial carcinoma in a large population-based case series[J]. Ann Oncol,2018,29(5):1180-1188.
[8] National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology (NCCN Guidelines):Uterine neoplasms.(Version 1. 2020)[EB/OL]. (2020-01-12)[2020-03-06]. https://www. nccn. org/professionals/physician_gls/pdf /uterine.pdf.
[9] Cree IA,White VA,Indave BI,et al. Revising the WHOification:female genital tract tumours[J]. Histopathology,2020,76(1):151-156.
[10] Berek JS,Matias-Guiu X,Creutzberg C,et al. FIGO staging of endometrial cancer:2023[J]. J Gynecol Oncol,2023,34(5):e85.
[11] Kang N,Zhang X,Wang Z,et al. Validation of a one-step genomics-based molecularifier for endometrial carcinoma in a large Chinese population[J]. Pathol Res Pract,2024,254:155152.
[12] 中国抗癌协会妇科肿瘤专业委员会,中华医学会病理学分会,国家病理质控中心. 子宫内膜癌分子检测中国专家共识(2021年版)[J]. 中国癌症杂志,2021,31(11):1126-1144.
[13] Talhouk A,Hoang LN,McConechy MK,et al. Molecularification of endometrial carcinoma on diagnostic specimens is highly concordant with final hysterectomy:Earlier prognostic information to guide treatment[J]. Gynecol Oncol,2016,143(1):46-53.
[14] Chapel DB,Yamada SD,Cowan M,et al. Immunohistochemistry for mismatch repair protein deficiency in endometrioid endometrial carcinoma yields equivalent results when performed on endometrial biopsy/curettage or hysterectomy specimens[J]. Gynecol Oncol,2018,149(3):570-574.
[15] Abdulfatah E,Wakeling E,Sakr S,et al. Molecularification of endometrial carcinoma applied to endometrial biopsy specimens:Towards early personalized patient management[J]. Gynecol Oncol,2019,154(3):467-474.
[16] Chung YS,Woo HY,Lee JY,et al. Mismatch repair status influences response to fertility-sparing treatment of endometrial cancer[J]. Am J Obstet Gynecol,2021,224(4):370.
[17] Zakhour M,Cohen JG,Gibson A,et al. Abnormal mismatch repair and other clinicopathologic predictors of poor response to progestin treatment in young women with endometrial complex atypical hyperplasia and well-differentiated endometrial adenocarcinoma:a consecutive case series[J]. BJOG,2017,124(10):1576-1583.
[18] Li L,Xiao Z,Wang Y,et al. Analysis of immunohistochemical characteristics and recurrence after complete remission with fertility preservation treatment in patients with endometrial carcinoma and endometrial atypical hyperplasia[J]. Arch Gynecol Obstet,2023,307(6):2025-2031.
[19] Van Gool IC,Rayner E,Osse EM,et al. Adjuvant Treatment for POLE Proofreading Domain-Mutant Cancers:Sensitivity to Radiotherapy,Chemotherapy,and Nucleoside Analogues[J]. Clin Cancer Res,2018,24(13):3197-3203.
[20] Schuurman T,Zilver S,Samuels S,et al. Fertility-Sparing Surgery in Gynecologic Cancer:A Systematic Review[J]. Cancers (Basel),2021,13(5):1008.
[21] Raffone A,Catena U,Travaglino A,et al. Mismatch repair-deficiency specifically predicts recurrence of atypical endometrial hyperplasia and early endometrial carcinoma after conservative treatment:A multi-center study[J]. Gynecol Oncol,2021,161(3):795-801.
[22] Dashti SG,Chau R,Ouakrim DA,et al. Female Hormonal Factors and the Risk of Endometrial Cancer in Lynch Syndrome[J]. JAMA,2015,314(1):61-71.
[23] Sparac V,Ujević B,Ujević M,et al. Successful pregnancy after hysteroscopic removal of grade I endometrial carcinoma in a young woman with Lynch syndrome[J]. Int J Gynecol Cancer,2006,16 Suppl 1:442-445.
[24] Marton I,Vranes HS,Sparac V,et al. Two cases of successful pregnancies after hysteroscopic removal of endometrioid adenocarcinoma grade I,stage IA,in young women with Lynch syndrome[J]. J Turk Ger Gynecol Assoc,2014,15(1):63-66.
[25] Britton H,Huang L,Lum A,et al. Molecularification defines outcomes and opportunities in young women with endometrial carcinoma[J]. Gynecol Oncol,2019,153(3):487-495.
[26] Karnezis AN,Leung S,Magrill J,et al. Evaluation of endometrial carcinoma prognostic immunohistochemistry markers in the context of molecularification[J]. J Pathol Clin Res,2017,3(4):279-293.
[27] Depreeuw J,Stelloo E,Osse EM,et al. Amplification of 1q32. 1 Refines the Molecular Classification of Endometrial Carcinoma[J]. Clin Cancer Res,2017,23(23):7232-7241.
[28] Auguste A,Genestie C,De Bruyn M,et al. Refinement of high-risk endometrial cancerification using DNA damage response biomarkers:a TransPORTEC initiative[J]. Mod Pathol,2018,31(12):1851-1861.
[29] Talhouk A,McConechy MK,Leung S,et al. Confirmation of ProMisE:A simple,genomics-based clinicalifier for endometrial cancer[J]. Cancer,2017,123(5):802-813.
[30] Talhouk A,McAlpine JN. Newification of endometrial cancers:the development and potential applications of genomic-basedification in research and clinical care[J]. Gynecol Oncol Res Pract,2016,3:14.
[31] Walker JL,Piedmonte MR,Spirtos NM,et al. Recurrence and survival after random assignment to laparoscopy versus laparotomy for comprehensive surgical staging of uterine cancer:Gynecologic Oncology Group LAP2 Study[J]. J Clin Oncol,2012,30(7):695-700.
[32] Janda M,Gebski V,Davies LC,et al. Effect of Total Laparoscopic Hysterectomy vs Total Abdominal Hysterectomy on Disease-Free Survival Among Women With Stage I Endometrial Cancer:A Randomized Clinical Trial[J]. JAMA,2017,317(12):1224-1233.
[33] Walker JL,Piedmonte MR,Spirtos NM,et al. Laparoscopy compared with laparotomy for comprehensive surgical staging of uterine cancer:Gynecologic Oncology Group Study LAP2[J]. J Clin Oncol,2009,27(32):5331-5336.
[34] Obermair A,Janda M,Baker J,et al. Improved surgical safety after laparoscopic compared to open surgery for apparent early stage endometrial cancer:results from a randomised controlled trial[J]. Eur J Cancer,2012,48(8):1147-1153.
[35] Galaal K,Donkers H,Bryant A,et al. Laparoscopy versus laparotomy for the management of early stage endometrial cancer[J].Cochrane Database Syst Rev,2018,10(10):CD006655.
[36] National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology (NCCN Guidelines):Uterine neoplasms.(Version 1. 2024)[EB/OL]. (2024-01-12)[2024-03-06]. https://www. nccn. org/professionals/physician_gls/pdf /uterine.pdf.
[37] Concin N,Matias-Guiu X,Vergote I,et al. ESGO/ESTRO/ESP guidelines for the management of patients with endometrial carcinoma[J]. Int J Gynecol Cancer,2021,31(1):12-39.
[38] Dai Y,Wang Z,Wang J. Survival of microsatellite-stable endometrioid endometrial cancer patients after minimally invasive surgery:An analysis of the Cancer Genome Atlas data[J]. Gynecol Oncol,2020,158(1):92-98.
[39] Dai Y,Wang J,Zhao L,et al. Tumor Molecular Features Predict Endometrial Cancer Patients' Survival After Open or Minimally Invasive Surgeries[J]. Front Oncol,2021,11:634857.
[40] Piulats JM,Matias-Guiu X. Immunotherapy in Endometrial Cancer:In the Nick of Time[J]. Clin Cancer Res,2016,22(23):5623-5625.
[41] Howitt BE,Shukla SA,Sholl LM,et al. Association of Polymerase e-Mutated and Microsatellite-Instable Endometrial Cancers With Neoantigen Load,Number of Tumor-Infiltrating Lymphocytes,and Expression of PD-1 and PD-L1[J]. JAMA Oncol,2015,1(9):1319-1323.
[42] 刘从容,刘岩. 子宫内膜癌传统组织病理与分子分型整合诊断的临床意义[J]. 中国实用妇科与产科杂志,2023,39(11):1073-1080.
[43] Reijnen C,Küsters-Vandevelde HVN,Prinsen CF,et al. Mismatch repair deficiency as a predictive marker for response to adjuvant radiotherapy in endometrial cancer[J]. Gynecol Oncol,2019,154(1):124-130.
[44] Wortman BG,Creutzberg CL,Putter H,et al. Ten-year results of the PORTEC-2 trial for high-intermediate risk endometrial carcinoma:improving patient selection for adjuvant therapy[J]. Br J Cancer,2018,119(9):1067-1074.
[45] León-Castillo A,de Boer SM,Powell ME,et al. Molecular Classification of the PORTEC-3 Trial for High-Risk Endometrial Cancer:Impact on Prognosis and Benefit From Adjuvant Therapy[J]. J Clin Oncol,2020,38(29):3388-3397.
[46] Kim SR,Tone A,Kim RH,et al. Understanding the clinical implication of mismatch repair deficiency in endometrioid endometrial cancer through a prospective study[J]. Gynecol Oncol,2021,161(1):221-227.
[47] Pasanen A,Loukovaara M,Bützow R. Clinicopathological significance of deficient DNA mismatch repair and MLH1 promoter methylation in endometrioid endometrial carcinoma[J]. Mod Pathol,2020,33(7):1443-1452.
[48] Son J,Carr C,Yao M,et al. Endometrial cancer in young women:prognostic factors and treatment outcomes in women aged ≤40 years[J]. Int J Gynecol Cancer,2020,30(5):631-639.
[49] McMeekin DS,Tritchler DL,Cohn DE,et al. Clinicopathologic Significance of Mismatch Repair Defects in Endometrial Cancer:An NRG Oncology/Gynecologic Oncology Group Study[J]. J Clin Oncol,2016,34(25):3062-3068.
[50] Bellone S,Roque DM,Siegel ER,et al. A phase 2 evaluation of pembrolizumab for recurrent Lynch-like versus sporadic endometrial cancers with microsatellite instability[J]. Cancer,2022,128(6):1206-1218.
[51] Mirza MR,Chase DM,Slomovitz BM,et al. Dostarlimab for Primary Advanced or Recurrent Endometrial Cancer[J]. N Engl J Med,2023,388(23):2145-2158.
[52] National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology (NCCN Guidelines):Uterine neoplasms.(Version 1. 2019)[EB/OL]. (2019-03-06)[2019-03-06]. https://www. nccn. org/professionals/physician_gls/pdf/uterine.pdf.
[53] Azad NS,Gray RJ,Overman MJ,et al. Nivolumab Is Effective in Mismatch Repair-Deficient Noncolorectal Cancers:Results From Arm Z1D-A Subprotocol of the NCI-MATCH (EAY131) Study[J]. J Clin Oncol,2020,38(3):214-222.
[54] Oaknin A,Tinker AV,Gilbert L,et al. Clinical Activity and Safety of the Anti-Programmed Death 1 Monoclonal Antibody Dostarlimab for Patients With Recurrent or Advanced Mismatch Repair-Deficient Endometrial Cancer:A Nonrandomized Phase 1 Clinical Trial[J]. JAMA Oncol,2020,6(11):1766-1772.
[55] Aghajanian C,Filiaci V,Dizon DS,et al. A phase Ⅱ study of frontline paclitaxel/carboplatin/bevacizumab,paclitaxel/carboplatin/temsirolimus,or ixabepilone/carboplatin/bevacizumab in advanced/recurrent endometrial cancer[J]. Gynecol Oncol,2018,150(2):274-281.
[56] Yonemori K,Yunokawa M,Ushijima K,et al. Lenvatinib plus pembrolizumab in Japanese patients with endometrial cancer:Results from Study 309/KEYNOTE-775[J]. Cancer Sci,2022,113(10):3489-3497.
[57] National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology (NCCN Guidelines):Uterine neoplasms.(Version 1. 2022) [EB/OL]. (2022-01-11)[2022-03-06]. https://www. nccn. org/professionals/physician_gls/pdf/uterine.pdf.
[58] Wei W,Ban X,Yang F,et al. Phase Ⅱ trial of efficacy,safety and biomarker analysis of sintilimab plus anlotinib for patients with recurrent or advanced endometrial cancer[J]. J Immunother Cancer,2022,10(5):e004338.
[59] 刘川,李秀琴. 晚期/复发子宫内膜癌的免疫靶向治疗[J]. 中国实用妇科与产科杂志,2023,39(11):1095-1098.
[60] 缪艺菲,周怀君. 子宫内膜癌内分泌治疗研究进展[J].中国实用妇科与产科杂志,2023,39(10):1049-1053.
声明:本文仅用于分享,如涉及版权等问题,请尽快联系我们,我们第一时间更正,谢谢!
