仅供医学专业人士阅读参考
点击右上方“关注”,准时接收每日精彩内容推送。
血栓栓塞是全球面临的重大健康挑战,是全球死亡和残疾的主要原因。血栓溶解剂(包括组织型纤溶酶原激活剂,tPA)是溶解血栓的唯一药理学方法。然而,这些药物疗效一般,严重的安全问题仍然存在。
基于此,来自美国北卡罗来纳州立大学的Brianna M. Vickerman团队开发了光响应性tPA负载红细胞(tPA-RBCsPhoto),以血栓部位为目标进行血栓溶解(图1)。本文描述了使用光来控制工程红细胞中tPA的释放以及随后体外血栓的降解。此外,作者还利用这项技术在体内恢复小鼠闭塞动脉的血流,使用的目标剂量比传统的全身tPA治疗低25倍。
相关研究成果以“Photothrombolytics: A light-driven technology for the targeted lysis of thrombi”为题于2024年12月17日发表在《Journal of Controlled Release》上。

图1 tPA-RBCsPhoto的图示
1.从红细胞中光控释放tPA
为了最大限度地增加每个细胞中可供释放的tPA量,在所有体外和体内研究中,都选择了100 μg tPA溶液的较高装载量。接下来,作者探索了光触发剂以光依赖性方式引发红细胞释放tPA的能力。光触发剂由两种脂化肽组成:蜂毒肽(一种强效溶解肽)和蜂毒肽抑制性前结构域(PD)的光裂解衍生物(图2a)。通过在有或无光以及存在或不存在一种或多种肽的情况下进行实验,检查了tPA-RBCs中tPA释放的光、PD和蜂毒素依赖性。通过tPA(通过 ELISA 检测)和血红蛋白(在550 nm处检测)的释放来测量RBC裂解;不含光触发器的受照RBC无法释放tPA或血红蛋白(图2b)。用暗对照证明了药物释放的光依赖性。tPA释放的百分比与每个样品的血红蛋白释放百分比一致,这支持了tPA释放是RBC裂解的结果这一观点。

图2 光触发tPA-RBC释放蛋白质
2.光控体外血凝块溶解
随后作者检查了RBCsPhoto释放的tPA的体外凝块溶解活性。通过添加凝血酶从全血中产生凝块,并将其转移到含有血浆的多孔培养皿中。通过在处理后立即测量每种溶液的血红蛋白吸光度以及随后在孵育60分钟后测量血红蛋白吸光度(图3b),可以量化凝块降解的程度。溶液中的血红蛋白吸光度可作为凝块溶解的指标。为了限制来自RBCsPhoto本身的背景信号,在光照(或暗光)后将每个RBC样本的上清液添加到凝块中。对照血凝块包括用缓冲液(空白)和游离tPA处理,其中最高tPA活性作为100%血凝块溶解对照。缓冲液-RBCsPhoto对照导致血凝块溶解可忽略不计,从而表明光激活的光触发器本身不会溶解血凝块。

图3 60分钟后各种治疗方法下体外血凝块降解的程度
3.血栓小鼠模型中的光依赖性血流恢复
确认RBCsPhoto光释放的tPA在体外具有显著的溶栓活性后,采用FeCl3诱导的血栓形成模型来评估光触发技术在体内的光依赖性溶栓效果(图4a),该模型通常用于研究新型溶栓剂的安全性和有效性。一旦血流稳定地减少到~0 mL/min,在30分钟内将tPA-RBCsPhoto注入尾静脉,并在治疗输注期间将颈动脉照亮或保持在黑暗中(图4b- c)。在血栓部位接受光照的动物中,86%的血流恢复,该组平均恢复的血流量为 76 ± 6%(图4d)。
最后,作者将tPA-RBCsPhoto的疗效与小鼠接受的标准tPA剂量(10 mg/kg)进行了比较。当全身输注此剂量时,83%的小鼠血管再通,平均血流量恢复率为 91 ± 20 %。使用此标准剂量tPA的恢复程度与接受照射的tPA-RBCsPhoto组相当。值得注意的是,tPA-RBCsPhoto的剂量(0.4 mg/kg)比标准剂量10 mg/kg低25倍,表明该技术的靶向作用可产生相当的疗效,但剂量明显较低。

图4 FeCl3诱发的小鼠血栓形成模型中的光控血凝块溶解
4.tPA-RBCsPhoto毒性调查
任何药物输送系统的一个重要特征是平台的安全性。因此,作者进行了为期一周的毒性研究,以调查使用光触发剂装载的tPA-RBCsPhoto治疗的潜在脱靶效应(图5)。在与FeCl3诱发的血栓形成模型相同的条件下,向小鼠注入tPA-RBCsPhoto。此外,用对照RBC治疗两组不同的小鼠(图5a)。小鼠在治疗后被跟踪了7天。作者检查了各种参数:在整个研究期间,动物的体重或体温没有出现显著变化(图5b-c)。在注射红细胞7天后,治疗组之间的红细胞参数和白细胞(WBC)计数没有显著差异(图5d-g)。
体内的红细胞主要由脾脏自然清除,但也部分由肝脏清除,因此作者仔细观察了这些器官的肝功能和组织学。所有组之间的脾脏重量没有差异(图5h)。血清血尿素氮(BUN)和肌酐浓度(肾功能指标)在治疗组之间没有差异(图5i-j)。肝脏生物标志物丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(APT)或碱性磷酸酶(ALP) 在所有组中也具有可比性(图5k)。此外,所有值均在该性别和菌株的已公布范围内。综合起来,这些数据表明tPA-RBC和含有光触发器的RBC都表现出良好的安全性。

图5 使用光触发器加载的tPA-RBCsPhoto未观察到毒性
5.凝血酶-RBCsPhoto的毒性调查
光疗技术的关键特征是循环系统充当药物库。这一前提假设非照射组织几乎不暴露于血源性药物,必须满足这一要求才能最大限度地减少副作用。因此作者通过对凝血酶进行第二项毒性研究,进一步研究了载药RBCsPhoto的安全性。凝血酶是一种强效凝血剂,即使在相对较低的浓度下以推注方式静脉注射也会致命。与上述tPA-RBCsPhoto研究类似,小鼠分别接受缓冲液RBCs、缓冲液- RBCsPhoto、凝血酶-RBCs或凝血酶- RBCsPhoto治疗(图6a)。
注射后对小鼠进行了7天的监测。在此期间,各组的体重或体温没有显著变化(图6b-c)。虽然与缓冲液-RBCs 对照组相比,免疫细胞比例(图6d)或脾脏重量(图6e)没有明显差异,但施用载有凝血酶的RBCs(有或没有光触发剂)的动物的白细胞计数在统计学上较低,并且RBCsPhoto的减少不具统计学意义(图6f)。所有组的红细胞计数和血红蛋白浓度都相当(图6g-h),与tPA-RBCsPhoto研究的结果一致。
在检查肾功能时,每个实验组的BUN水平相似(图6i)。与缓冲液-RBCs组相比,含有光触发剂的组的血清肌酐浓度略低,但具有统计学意义,但在所有组中均保持在已公布的参考值范围内(图6j)。所有组的肝酶ALT和AST活性相当,尽管凝血酶-RBCs组的ALP活性略有升高(图6k- m)。总的来说,这些结果支持了光触发剂有希望的安全性以及蛋白质治疗剂可以在红细胞载体内运输以减少副作用的观点。
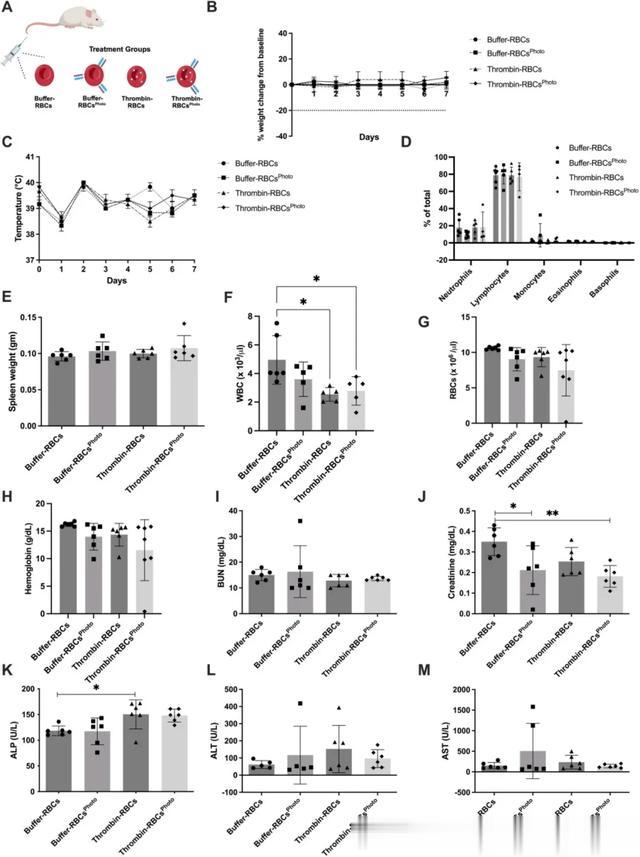
图6 光触发剂载有凝血酶-红细胞的光毒性研究未观察到体内脱靶效应
在这项研究中,作者研究了光触发技术在控制溶栓剂(特别是tPA)向患病部位输送方面的实用性。通过使用红细胞作为tPA的血管内载体,实现了约3 μM 的高内部tPA负载浓度。在红细胞表面加入光触发剂使得光可用于控制tPA从其载体中的释放。体外凝血试验和使用动脉血栓形成小鼠模型的体内研究均验证了这一策略。值得注意的是,光介导的血流恢复是在tPA剂量比标准治疗剂量低25倍的情况下实现的,这突显了减少副作用的潜力。此外,在用装载tPA的RBCsPhoto治疗的小鼠中观察到的无毒特性使该平台成为在更大的临床前模型中进一步评估的有希望的候选者。
了解更多
关注“EngineeringForLife”,了解更多前沿科研资讯
