
引言
真核生物的基因组DNA包裹在染色质中,因此真核DNA复制发生在染色质环境下。染色质的基本结构单位是核小体,由147 bp DNA缠绕的组蛋白八聚体组成,组蛋白多种翻译后修饰是表观遗传信息的承载基础。DNA复制时染色质打开然后重新建立,使得DNA复制和染色质复制的偶联,在此过程中亲本染色质携带的表观遗传信息被分配到新合成的子链DNA,因此染色质重建也是表观遗传信息继承的基础,维持基因组和表观基因组稳定。染色质重建的起始步骤是DNA复制偶联的核小体组装,同时也是表观遗传信息继承的关键一环,其核心是DNA合成和核小体组装的偶联。
碱基配对形成了双螺旋结构的DNA,两条链的互补性决定了DNA是以半保留的方式进行复制。组成DNA的两条链是反向平行的,因此解螺旋的DNA的两条单链具有方向,一条是5’-3’,另一条链是3’-5’,但是DNA聚合酶都是5’-3’方向进行合成的,导致复制叉上两条链的合成方向相反。由此DNA复制的一条链是向复制叉前进的方向连续合成,称之为前导链,而另一条链的合成方向和复制叉前进的方向相反,先合成小片段DNA然后连接成完整的DNA分子,这个机制是冈崎夫妇发现的,所以这些短片段称之为冈崎片段,这条链称之为滞后链。滞后链冈崎片段合成先是Pol α合成带有一段RNA的DNA引物,然后发生聚合酶Pol α到 Pol δ的转换,Pol δ继续合成冈崎片段。其间Pol δ通过链置换反应入侵前一个冈崎片段,将含有RNA的保真度较低引物置换,形成单链翘起,进而招募Fen1等核酸酶进行切除被置换的单链DNA,产生的缺口被DNA连接酶(酵母中是Cdc9)连接,保障冈崎片段成熟,形成完整连续的滞后链DNA。伴随冈崎片段合成,核小体也会迅速组装,以免DNA暴露。前期Whitehouse和Smith的研究表明,真核生物的冈崎片段大小与核小体DNA和连接DNA的长度相当,且连接位置在核小体近中轴区,提出滞后链上核小体可以阻碍Pol δ的行进决定冈崎片段的长度【1, 2】。由于没有直接证据,核小体组装和冈崎片段成熟过程的协同机制尚不明确,李晴课题组发展了电镜核酸技术,对此机制进行了解析。
2024年8月9日,北京大学生命科学学院、北大-清华生命科学联合中心李晴课题组在Science Advances发表题为DNA polymerase δ subunit Pol32 binds histone H3-H4 and couples nucleosome assembly with Okazaki fragment processing的研究论文,巧妙利用DNA连接酶降解体系,应用电镜核酸技术观察酵母细胞中DNA复制叉中间体结构,发现核小体中组蛋白和DNA的相互作用决定了链置换的位置,而且DNA聚合酶δ的Pol32亚基在C端有一个组蛋白H3-H4的结合区域,可以直接贡献于后随链上的核小体组装,揭示了后随链上DNA合成和核小体组装的协同机制。
 研究者在芽殖酵母中利用AID(Auxin-induced degradation)系统诱导Cdc9在DNA复制早期快速降解,抑制冈崎片段末端的连接,进而在透射电镜下观察DNA复制中间体,发现在超过94%的复制叉上都含有翘起的DNA结构(flap structure),并且这个翘起结构主要集中在其中一条子链上,进一步的分析表明有翘起发生在滞后链 (图1)。通过测量翘起结构 (Flap) 的两个主要特征 (图2):Flap本身的长度和相邻Flap的间距,研究者发现,1)在野生型背景下,Flap的长度集中分布在52 nt左右,其长度受到Pol δ的链置换活性和Fen1的核酸酶活性调控,而且Flap的长度分布具有13-15 nt的步长,可能是由核小体中周期性组蛋白和DNA相互作用障碍链置换合成造成的。2)相邻Flap的间距与冈崎片段长度相似,集中在190 bp左右。该间距的增大来自于DNA复制偶联的核小体组装突变,例如经典组蛋白分子伴侣CAF-1大亚基Cac1的缺失突变(cac1D)以及Mcm2结合组蛋白突变mcm2-3A,两个突变分别会导致新合成组蛋白的组装缺陷和旧组蛋白回收缺陷,这个间距增加到280bp左右,表明冈崎片段的合成受核小体组装程度调节。
研究者在芽殖酵母中利用AID(Auxin-induced degradation)系统诱导Cdc9在DNA复制早期快速降解,抑制冈崎片段末端的连接,进而在透射电镜下观察DNA复制中间体,发现在超过94%的复制叉上都含有翘起的DNA结构(flap structure),并且这个翘起结构主要集中在其中一条子链上,进一步的分析表明有翘起发生在滞后链 (图1)。通过测量翘起结构 (Flap) 的两个主要特征 (图2):Flap本身的长度和相邻Flap的间距,研究者发现,1)在野生型背景下,Flap的长度集中分布在52 nt左右,其长度受到Pol δ的链置换活性和Fen1的核酸酶活性调控,而且Flap的长度分布具有13-15 nt的步长,可能是由核小体中周期性组蛋白和DNA相互作用障碍链置换合成造成的。2)相邻Flap的间距与冈崎片段长度相似,集中在190 bp左右。该间距的增大来自于DNA复制偶联的核小体组装突变,例如经典组蛋白分子伴侣CAF-1大亚基Cac1的缺失突变(cac1D)以及Mcm2结合组蛋白突变mcm2-3A,两个突变分别会导致新合成组蛋白的组装缺陷和旧组蛋白回收缺陷,这个间距增加到280bp左右,表明冈崎片段的合成受核小体组装程度调节。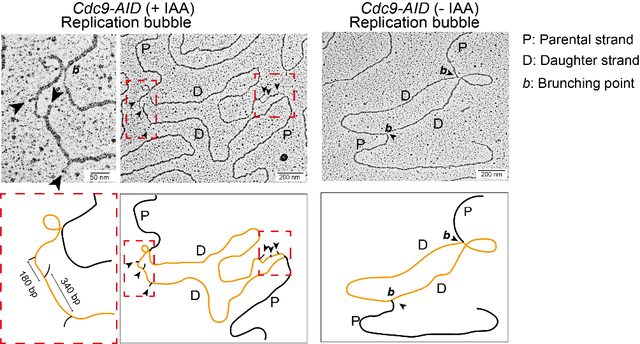
图1:电镜核酸技术观察DNA连接酶降解后的复制叉结构。图示复制泡结构;左图是Cdc9降解后,右图是未降解对照。(Credit: Science Advances)
研究者在Pol δ亚基非催化亚基Pol32缺失突变中观察到flap间距变大,和上述提到核小体组装突变cac1D以及mcm2-3A的间距变化类似 (图2)。研究者进一步通过体内、体外分析直接证明了Pol32的C端可以直接结合组蛋白H3-H4,并通过ReIN-Map方法证明Pol32调节滞后链上的核小体组装。最近有两篇报道也分别揭示Pol32参与亲本组蛋白往后随链的递送,与我们的结论一致【3, 4】。
图2:翘起结构 (Flap)的两个特征:Flap的长度 (A)和相邻Flap的间距(B)(Credit: Science Advances)
综上,李晴课题组应用电镜核酸技术直接观察复制叉滞后链的分子事件,发现Pol32介导了核小体组装,进而提供了冈崎片段合成过程中链置换的终止位置,为冈崎片段成熟和核小体组装协同机制提供直接证据(图3)。
图3:Pol32介导核小体组装与冈崎片段成熟协同机制。(i) Pol δ催化冈崎片段合成;(ii) 冈崎片段合成后,通过Pol32快速组装H3-H4四聚体到新合成的DNA上;(iii) Pol δ侵入先前产生的具有新生核小体的冈崎片段;(iv) 冈崎片段合成的重复循环,形成反应核小体间距的flap间距;在Pol32缺失突变体中,核小体组装水平下降导致核小体屏障的减少,进而导致冈崎片段增长。(Credit: Science Advances)
参考文献
1. D. J. Smith, I. Whitehouse, Intrinsic coupling of lagging-strand synthesis to chromatin assembly. Nature 483, 434-U480 (2012).2. N. C. Koussa, D. J. Smith, Post-replicative nick translation occurs on the lagging strand during prolonged depletion of DNA ligase I in. G3-Genes Genom Genet 11 (2021).3. C. Tian et al., DNA polymerase delta governs parental histone transfer to DNA replication lagging strand. Proc Natl Acad Sci U S A 121, e2400610121 (2024).4. A. Serra-Cardona et al., The PCNA–Pol δ complex couples lagging strand DNA synthesis to parental histone transfer for epigenetic inheritance. Science Advances 10, eadn5175 (2024).http://doi.org/10.1126/sciadv.ado1739责编|探索君
排版|探索君
文章来源|“BioArt”
End
