斜视患者眼外肌(EOM)的病理改变是正确诊断、阻断遗传以及个性化治疗的必备要求。深入理解斜视患者肌细胞生物学特性可能为该类疾病提供新的治疗思路。
斜视是指双眼无法保持正常对位的状态,其本质是眼外肌协调功能障碍。当支配眼球运动的六条肌肉中至少一条出现功能异常时,即可导致眼位偏斜。正常情况下,双眼各六条眼外肌需对称收缩并施加均衡作用力以实现协同运动。若这种力学平衡被破坏,则引发眼位异常。
斜视手术通过调整眼外肌位置来矫正眼位偏斜,通常在全身麻醉下进行。鉴于眼位异常的病因复杂,当非侵入性治疗无效时需考虑手术治疗。手术方式取决于斜视类型:内斜视表现为眼球向内偏转(集合性斜视),外斜视则为眼球向外偏转(分散性斜视)。通过松弛(减弱)或缩短(加强)眼外肌可实现矫正目的。经专业眼科检查及视轴测量后确定具体调整量。直肌后徙术通过将肌肉切断并重新缝合于眼球更后端实现肌力减弱;直肌切除术和折叠术则用于增强肌力——前者切除部分肌肉后重新固定于原止点,后者通过肌肉折叠缝合于巩膜实现强化。
ADP/ATP转位酶1(ANT1)由SLC25A4基因编码,作为线粒体内膜通道蛋白,负责介导ADP进入线粒体及ATP向外转运以供细胞能量代谢。ANT1还可参与构成线粒体通透性转换孔,该结构不仅调控分子跨膜转运,还在细胞凋亡中起关键作用。ANT1编码基因突变已被证实与肌肉及脑部退行性疾病相关,佳学基因检测正通过致病基因鉴定基因解码以揭示其致病机制。Coyne等研究发现,某些ANT1蛋白编码基因突变并非直接影响其核苷酸转运功能,而是通过阻碍其他蛋白质向线粒体的运输引发疾病,这一发现对理解线粒体蛋白相关疾病机制具有重要意义,或将改变相关治疗策略。研究显示,ANT1错义突变可导致显性遗传病,引发成人及迟发型常染色体显性进行性眼外肌麻痹(adPEO),临床表现为上睑下垂、眼肌麻痹及伴随线粒体DNA(mtDNA)多重缺失的骨骼肌无力。显性ANT1突变患者还可出现感音神经性耳聋、阵挛性发作、双相情感障碍、皮质萎缩及痴呆等神经系统症状。
目前关于斜视患者眼外肌mtDNA改变的基因检测甚少,因此佳学基因解码通过斜视手术患儿眼外肌mtDNA变异情况。佳学基因认为斜视患者眼外肌功能失调可能部分源于mtDNA修饰,故本研究核心目标是验证斜视儿童眼外肌是否存在mtDNA突变。纳入标准为调节性斜视和婴幼儿型斜视,排除标准为合并综合征(如Moebius综合征)、早产儿斜视及伴有神经系统疾病的斜视病例。
如何获取高纯度线粒体DNA?采用Qiagen试剂盒从组织材料中分离mtDNA。具体步骤如下:
组织匀浆:将采集的肌肉切片组织(约50 mg)在匀浆缓冲液(含0.25 M蔗糖、10 mM EDTA、30 mM Tris/HCl,pH=7.5)中充分匀浆;
离心去核:匀浆液转移至1.5 mL离心管,4℃、1000× g离心1分钟,沉淀细胞核及碎片;
线粒体沉淀:取上清液于4℃、12000× g离心10分钟,获得线粒体沉淀;
线粒体悬浮:弃上清,沉淀重悬于缓冲液(含0.15 M NaCl、10 mM EDTA、10 mM Tris/HCl,pH=8.0),终体积50 μL;
碱裂解:加入100 μL新鲜配制的SDS-NaOH溶液(1% SDS中含0.18 M NaOH),涡旋混匀后冰浴孵育5分钟;
中和反应:加入75 μL预冷(约0℃)的碱性裂解液(3 M乙酸钾/5 M乙酸体系:将11.5 mL冰乙酸加入60 mL 5 M CH₃COOK溶液与28.5 mL H₂O混合),涡旋轻柔混匀后冰浴5分钟;
杂质去除:4℃、12000× g离心5分钟,收集上清液;
有机萃取:上清液中加入等体积酚/氯仿/异戊醇(25:24:1)混合液,涡旋剧烈震荡后室温12000× g离心2分钟;
DNA沉淀:取水相转移至新管,加入2倍体积预冷无水乙醇,混匀后室温静置15分钟,室温12000× g离心2分钟获得mtDNA沉淀;
纯化:沉淀用1 mL 70%乙醇洗涤,减压干燥1–3分钟;
溶解:干燥后沉淀溶于含RNase的TE缓冲液(20 μg/mL RNase,pH=8.0的TE缓冲液:10 mM Tris-HCl,1 mM EDTA)。
佳学基因如何对线粒体DNA进行NGS测序?mtDNA的二代测序分析通过实时定量PCR检测mtDNA缺失水平及拷贝数,并定量分析ANT1、TYMS和PEO1的cDNA表达量。
PCR扩增:采用标准反应体系(含无菌超纯水、dNTP混合物、Taq DNA聚合酶、10×PCR反应缓冲液及50 mM MgCl₂)对ANT1、TYMS和PEO1基因进行扩增。反应条件为:94℃预变性5分钟;35个循环(94℃变性1分钟,59.1℃退火1分钟,72℃延伸2分钟);72℃终延伸10分钟。PCR产物经12%聚丙烯酰胺凝胶电泳分析。
二代测序:采用Illumina TruSeq PCR-free建库试剂盒(美国圣地亚哥Illumina公司)对mtDNA进行文库构建,使用Illumina HiSeq X测序平台(美国圣地亚哥Illumina公司)检测ANT1、TYMS和PEO1基因的缺失/重复突变。同时采用包含281个线粒体相关核基因的NGS panel筛查常见线粒体病相关突变。
突变验证:所有变异均通过Sanger测序验证。PCR产物纯化后直接测序,将检测到的变异(包括错义突变、剪接位点突变及小片段插入缺失)与dbSNP数据库、人类基因突变数据库(HGMD)及文献数据进行比对。对目标变异先证者及其父母或兄弟姐妹进行Sanger测序家系验证。
斜视致病基因鉴定基因为什么要做线粒体基因检测?本研究共收集15例斜视手术患者的眼外肌样本,其中:
内斜视患者:8例(手术干预眼内直肌)
外斜视患者:7例(手术干预眼外直肌)
手术方案:
外斜视组:切除内直肌并进行病理检查
内斜视组:切除外直肌并进行病理检查
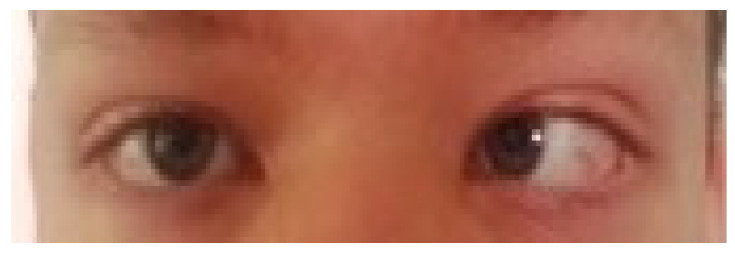
大角度偏斜患者(偏斜角>10°):除切除目标肌肉外,同期行对侧肌肉后徙术(图1-2)
表1. 内斜视手术患者(偏斜角>10°)的病理与基因检测结果(OS:左眼;OD:右眼;ANT1:ADP/ATP转位酶1;C:胞嘧啶;G:鸟嘌呤;A:腺嘌呤;T:胸腺嘧啶)
性别出生日期手术日期手术类型病理评估mtDNA突变检测男2002年10月2014年7月15日左眼内斜视:内直肌后徙术+外直肌切除术无病理改变ANT1 C缺失男2008年2月2014年6月9日左眼内斜视:内直肌后徙术+外直肌切除术无病理改变未检出突变男2010年7月2014年6月3日左眼内斜视:内直肌后徙术+外直肌切除术无病理改变未检出突变男2005年12月2014年5月20日右眼内斜视:内直肌后徙术+外直肌切除术无病理改变ANT1 G缺失女2011年11月2014年6月4日右眼内斜视:内直肌后徙术+外直肌切除术局灶性肌纤维轻度萎缩ANT1 A缺失女2009年7月2014年5月21日左眼内斜视:内直肌后徙术+外直肌切除术肌束边缘部分肌纤维萎缩ANT1 G缺失女2003年7月2014年8月26日左眼内斜视:内直肌后徙术+外直肌切除术无病理改变ANT1 T缺失 + C>A置换女2008年11月2014年8月12日左眼内斜视:内直肌后徙术+外直肌切除术无病理改变ANT1 G缺失注:2棱镜度≈1°偏斜角
表2. 外斜视手术患者(偏斜角<10°)的病理与基因检测结果(OS:左眼;OD:右眼;ANT1:ADP/ATP转位酶1;T:胸腺嘧啶;C:胞嘧啶;A:腺嘌呤;G:鸟嘌呤)
性别出生日期手术日期手术类型病理评估mtDNA突变检测女2002年10月2014年7月22日右眼外斜视:内直肌切除术肌束边缘局灶性肌纤维萎缩ANT1 T缺失男2009年9月2014年5月28日右眼外斜视:内直肌切除术无病理改变ANT1 269位点C>T置换男2007年12月2014年8月13日左眼外斜视:内直肌切除术无病理改变ANT1 T缺失 + C>A置换女2010年10月2014年7月23日左眼外斜视:内直肌切除术无病理改变ANT1 G缺失女2011年8月2014年7月8日右眼外斜视:内直肌切除术无病理改变ANT1 269位点C>T置换女1999年11月2014年6月11日左眼外斜视:内直肌切除术无病理改变ANT1 T缺失男2002年2月2014年8月12日左眼外斜视:内直肌切除术无病理改变未检出突变注:2棱镜度≈1°偏斜角
眼外肌(EOM)组织病理学评估显示,大部分肌纤维形态正常。在15例样本中仅3例出现局灶性肌纤维萎缩特征:
内斜视手术患者(2例):观察到肌束边缘部分肌纤维萎缩(表1)
外斜视手术患者(1例):发现肌束边缘局灶性肌纤维萎缩(表2)
基因检测结果:TYMP与PEO1基因:未检测到突变
ANT1基因:15例受检者中12例存在点突变(缺失或碱基置换),具体表现为:
内斜视组突变谱(表1):缺失突变:G缺失(3例)、C缺失(1例)、A缺失(1例)
复合变异:T缺失伴C>A置换(1例)
阴性结果:2例未检出突变
缺失突变:T缺失(3例)
p
碱基置换:C>A置换(2例)
复合变异:G缺失伴C>A置换(1例)
阴性结果:1例未检出突变

眼外肌(EOM)与其他骨骼肌存在显著差异:
功能特性:EOM需在更广的动态范围内响应,其结构、功能、生化及免疫特性均不同于普通骨骼肌[4]。
微观特征:
快颤纤维(由单一粗大运动神经元通过"en plaque"神经肌肉接头支配)
慢张力纤维(由多个细小运动神经通过"en grappe"末梢支配)
肌纤维更细小,收缩速度可达其他骨骼肌的10倍以上
神经支配密度极高(神经纤维与肌纤维比例为1:7,普通骨骼肌为1:100)
含两种特殊纤维类型:
富含弹性组织带[6]
中间丝蛋白:结蛋白(desmin)、波形蛋白(vimentin)与巢蛋白(nestin)的分布模式显著区别于体肌[6]
眼外肌的分子特异性EOM具有独特的分子特征:
肌球蛋白重链亚型:高比例快肌亚型(MyHC-eom)、张力型亚型(MyHC-sto)及持续表达的发育期亚型(MyHC-emb/MyHC-pn)[7]
钙调控机制:肌浆网膜离子泵(SERCA)密度更高[7]
成人斜视患者的眼外肌改变斜视的EOM病理机制尚未完全阐明,但已发现以下异常:
细胞增殖:内直肌功能不足者中,活化细胞与卫星细胞数量上调
氧化还原失衡:恒定性外斜视患者内直肌的神经元型一氧化氮合酶(nNOS)水平显著升高,而过氧化氢酶表达降低[9]
本体感受器损伤:
电子显微镜显示斜视肌梭结构紊乱,神经成分消失,线粒体数量减少
提示本体感觉传导异常可能参与斜视发病
细胞外基质改变:
间歇性外斜视患者内直肌中聚集蛋白聚糖(aggrecan)含量随年龄下降,且与运动功能相关
恒定性外斜视者纤维连接蛋白(fibronectin)显著低于对照组
儿童斜视的眼外肌特征组织病理学:
光镜可见肌纤维形态异常、肌节破坏、胶原增生及空泡形成
电镜显示肌丝紊乱、线粒体异常及糖原沉积
神经肌肉接头:
先天性斜视患者远端肌腱连接处的神经支配肌腱圆柱体(IMCs)结构改变
巩膜肌腱连接处功能异常可能是关键病理环节
遗传倾向:
非综合征性婴儿型内斜视可能与3p26.3–26.2和6q24.2–25.1染色体区域相关
斜视的分子遗传学基因表达谱:
斜视EOM中604个基因表达异常:细胞外基质相关基因上调,收缩相关基因下调
胰岛素样生长因子1(IGF1)表达增加可能影响肌质量与收缩动力学
肌生成基因:MYOD1、MYOG等7个肌源性基因在斜视肌中表达普遍降低
线粒体机制:
ANT1基因突变可通过破坏mtDNA稳定性导致肌肉及神经系统退行性变
本研究发现12/15例斜视儿童存在ANT1点突变,首次揭示mtDNA变异可能参与斜视发病
如何进一步增加斜视基因检测的准确性?需进一步解析斜视与非斜视EOM的转录组差异,深化分子机制认识以开发靶向治疗。当前NGS研究将持续评估mtDNA外显子变异。