
替代亲核取代反应通过使用在亲核中心带有离去基团的碳负离子实现硝基芳族化合物和杂芳族化合物中氢的亲核取代。
反应机理众所周知,聚硝基芳烃与各种亲核试剂(Meisenheimer complexes)形成稳定的加合物,与含氢碳原子的键形成速度比含其他取代基(包括卤素)的碳原子更快。然而,直到20世纪70年代末,Mieczysław Makosza详细阐述了亲电芳烃中氢的直接亲核取代反应,才知道氢的一般亲核取代方法。
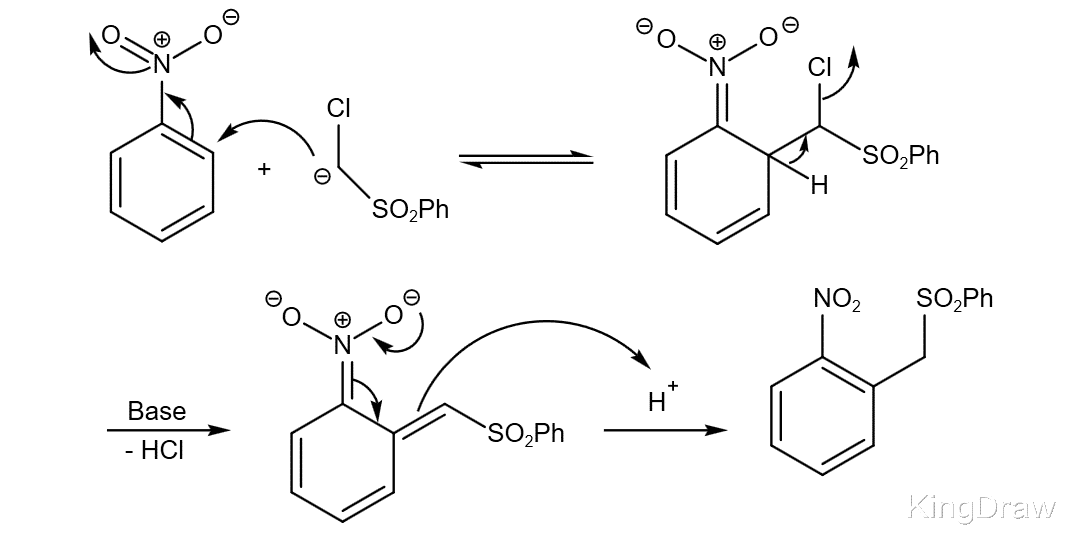
Mieczysław Makosza假设由在碳负离子中心含有离去基团的碳负离子形成的σ加合物会继续失去该离去基团。 这首先通过用氯甲基苯基砜处理硝基苯来证明。

由于在这种情况下氯化物可作为离去基团起作用,因此该反应被称为“氢的亲核取代”(VNS)。
在典型的替代性亲核取代中,硝基芳烃与通常由活性亚甲基产生的碳负离子通过与也在随后的消除步骤中消耗的碱反应而发生反应。 因此,该反应最好在两个以上当量的强碱下进行。 正确选择溶剂和碱可确保活性亚甲基快速脱质子,并从σ加合物中快速消除β。 形成的硝基苄基碳负离子是彩色的(蓝色,红色等),具有一定的诊断价值。 酸性处理导致产生产品。
对于取代的硝基芳烃的VNS:4-取代的硝基芳烃仅产生一种产物(VNS邻位至硝基),而2-和3-取代的硝基芳烃通常导致异构体产物的混合物(VNS邻位和对硝基)。在卤代硝基芳烃中,VNS通常比卤素的亲核亲核取代要快,除了2-或4-F取代的硝基芳烃外,氟化物是更好的离去基团。
阴离子的直接共轭不利于亲核取代,例如在硝基酚盐的情况下。 由于硝基苄基碳负离子本身不添加亲核试剂,因此该反应对于单取代非常有选择性。 然而,第二或第三硝基取代基补偿了负电荷,尽管此处取代基的引入速率非常不同。

据报道,氯甲基砜与杂环如2-和3-硝基噻吩,2-硝基呋喃,2-,3-和4-硝基吡啶等发生了VNS反应。
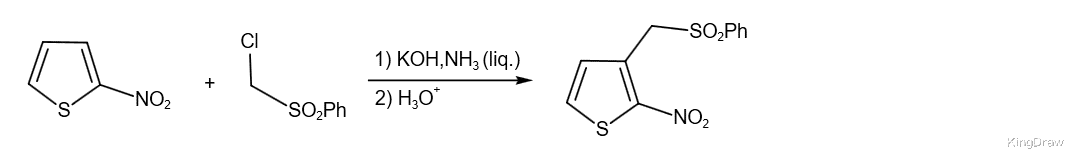
对于硝基吡咯,由于硝基吡咯阴离子本身不经历VNS,因此必须用烷基取代酸性N-H。
对于用磺酰基或含磷取代基稳定的碳负离子,氯是一个方便的离去基团。 但是,对于α-氰基烷基化,(硫代)苯氧基腈(离去基团:PhO或PhS)通常可以确保更高的收率,因为氯腈在碱性介质中经常不稳定或经历快速的自缩合。 对于α-羰基烷氧基烷基化,通常使用含PhS的酯的碳负离子,尽管α-氯丙酸乙酯和α-氯丁酸乙酯也可提供VNS产品,但收率通常很高。 以下是合适的亲核试剂的一些例子:

由于添加和消除步骤均对空间效应敏感,因此叔碳负离子(R:Me,Ph,...)最好在对位反应。

