活菌治疗近年来受到广泛关注。
益生菌的靶向重新设计,如乳杆菌属,拟杆菌属,双歧杆菌属和一株原生大肠杆菌Nissle 1917(ECN)从人体肠道分离出来,赋予了他们智能生产和传递治疗产品的功能。
在常用的益生菌中,非致病性ECN由于其众所周知的遗传背景而成为益生菌诊断和治疗工程中的流行底盘细菌。
这一物种可以更容易地通过基因操作来提供自然保护,以抵御沙门氏菌和福氏志贺氏菌等病原体的入侵。
此外,它还能减少典型的促炎细胞因子的释放,包括白细胞介素1β(IL-1β)、白细胞介素6(IL-6)和肿瘤坏死因子-α(肿瘤坏死因子-α)。
抗炎细胞因子白介素10(IL-10)和转化生长因子-β(转化生长因子-β)水平也上调。由于一些研究人员认为ECN对肠道的定植不如类杆菌属种。
工程益生菌大肠杆菌Nissle 1917(ECN)有望用于各种疾病的诊断和治疗。
但是,引入的质粒通常需要抗生素来维持遗传稳定性,并且ECN中的隐藏质粒通常被消除,以避免可能改变益生菌固有特性的质粒不相容。
将苯丙氨酸降解途径改造成ECN菌株可以将异常积累的苯丙氨酸转化为反式肉桂酸酯,然后反式肉桂酸酯可由宿主代谢成马尿酸盐并从尿中排泄。
为了构建遗传稳定的工程菌,通常是将功能DNA直接插入到染色体中,而低拷贝插入的基因往往难以达到预期的输出效果。
将含有可诱导表达盒的质粒载体引入益生菌有助于对日益复杂的遗传电路进行体外测试,但实际上并不接受同时给予抗生素和益生菌。
ECN含有两个高度稳定的可复制的隐质粒:pMUT1(PM1)和pMUT2(PM2)。在37°C的LB中,PM1的拷贝数约为132±11,PM2的拷贝数约为97±36.3。
更重要的是,PM2上的RelB-Rele毒素-抗毒素系统在维持质粒方面起着重要作用。
PM1具有典型的ColE1复制起点,而PM2具有ColE2样复制位点和ColE1样动员位点。
工程益生菌的定植确实是一个高度复杂的过程,涉及对本地肠道利基和粘液结合蛋白的竞争。
外来益生菌往往无法获得相对于单个肠道本地微生物的绝对竞争优势,从而导致长期定居的失败。
然而,ECN有限的定植能力可能是缓解基因工程在药物中应用的担忧的重要安全保证。
通过对这两个隐藏质粒pMUT1(PM1)和pMUT2(PM2)进行工程并将其用作构建功能通路的载体,可以利用它们高拷贝的优势来实现持续的高产,同时可以在没有抗生素压力的情况下保持工程隐藏质粒的遗传稳定性。
在益生菌E.Coli Nissle 1917主要作为合成途径工程的标准载体进行测试。
首先,使用CRISPR-Cas9工具测试了通过质粒序列上的单个识别切除位点消除PM1和PM2质粒的效率。
之后,将ECN天然组合调控元件控制下的荧光蛋白表达盒插入到工程隐藏质粒上的不同测试位置。
通过这种方式,验证了质粒上候选整合位点的强度。
然后,将经典药物前体水杨酸的核心合成途径基因(pchB和entC)引入到工程隐藏载体中,以测试利用工程隐藏载体构建功能途径的合成效率。
利用携带上游途径限速基因(PPSA、tktA、arg和arol)的隐藏质粒来探索代谢工程对产物合成的增强作用。
隐藏质粒的消除和基因组DNA的编辑用10 mM L-阿拉伯糖制备携带pCAS质粒的ECN感受态细胞。将N20序列插入到原间隔邻接基序(PAM)序列的上游,构建了pTargetF载体。
供体DNA片段通过上游和下游同源序列的融合获得。
将pTargetF(100 Ng)转移到电穿孔感受态细胞中,进行质粒固化。在细胞中加入额外的400 ng供体DNA,即可实现基因敲除或敲入。
30℃复苏1h后,接种于含卡那霉素(50μg/L)和壮观霉素(50μg/L)的LB琼脂平板上,30℃培养12~16h。
转化子中的pCAS和pTargetF质粒根据标准方案消除。
在不添加供体DNA的情况下,将设计好的pTargetF载体转移到pTargetF载体上,经双重抗生素筛选后,即可消除隐蔽载体。
潜质粒转化为表达载体:为了便于体外构建这两个隐含载体,分别扩增了卡那霉素和安普霉素的表达框,并分别插入到PM1的S2位和PM2的S3位。
构建的PM1-KanR和PM2-APRR两个重组质粒可用于体外构建和筛选。
基因表达强度:通过测量含有重组隐蔽质粒的菌株的荧光强度来评估每个插入位点的表达强度。
该菌株在37℃的LB型固体培养基上过夜,单菌落在1mL含抗生素的LB液中培养6h,以13000×g收集细胞10min,在PBS中洗涤一次,再悬浮在1mLPBS缓冲液中,然后用平板阅读器测量荧光强度。激发和发射波长分别为485和528 nm。

图1.ECN菌株中潜伏质粒(pMUT1和pMUT2)的消除目标产物合成
来自ECN的entC和来自荧光假单胞菌的pchB的共表达可构建SA的核心合成途径。
从粗糙脉孢菌中导入ncegt1和从Clavicep Purpurea中导入cpegt2,即可合成EGT。
内源性结构性强启动子putr ssrA-putr inC-rplT(PUTR4)被用来驱动插入基因的表达。
将工程菌在LB中的过夜培养物(1%)接种到含有适当抗生素的M9培养基中。
菌株在37℃下猛烈摇动(300rpm)培养。分别于培养8、16、24、36、48h各取1mL,用于SA产量的测定。
EGT的合成需要加入10 mM的S-腺苷蛋氨酸(SAM)。第7天取上清液,13000×g离心10min,高效液相色谱(HPLC)分析。
质粒消除程序与野生型ECN相比,无质粒ECN可能与修饰的质粒更相容,因为工程载体可能会保留隐藏质粒的天然复制机制。
高效的CRISPR-Cas9系统被用来消除隐藏的质粒。
为了测试不同切割位点的质粒消除效率,随机选择了三个sgRNA识别位点/Cas9切割位点用于PM1固化(图1A)。
对于PM2质粒,在其序列上注释了一个毒素-抗毒素系统,该系统可以促进质粒的遗传稳定性。
因此,为了确保成功治愈,设计了五个sgRNA识别位点/Cas9切割位点,其中一个位于RelB-Rele毒素-抗毒素系统中(图1A)。
从理论上讲,由于ECN株缺乏自我重组修复能力,潜伏质粒将在sgRNA的引导下被Cas9蛋白定向切割,从而实现质粒治疗的目的。
在8次sgRNA引导的Cas9切割实验中,均成功获得了去除隐质粒的ECN菌株。
在质粒PM1(图1B)的固化过程中,通过选择的三个位点的切割,获得了效率可接受的阳性突变体。
当Cas9在E1c位点切割该序列时,质粒丢失率降至3.3%(60个菌落中有2个阳性克隆)。切削物阳性率以E1c点最低,但仍可接受。
在构建无PM2菌株(图1C)的过程中,可以通过在所有五个设计的识别位点上切割来获得突变体。
卵裂点E2d的治愈率最高,达23.3%(60个克隆中有14个阳性克隆),而E2b和E2c位点的卵裂率最低,为5.0%(60个克隆中有3个阳性克隆)。
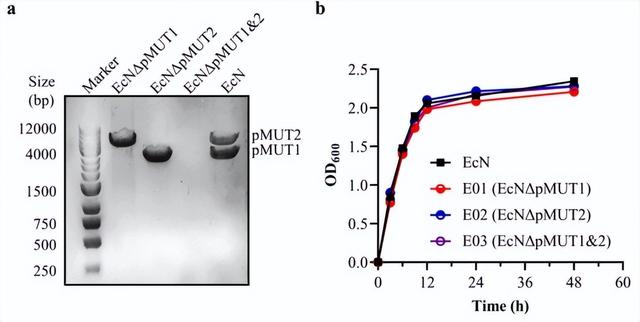
消除EcN菌株中的两个隐性质粒
荧光蛋白的隐蔽表达载体将GFP和GFP(SfGFP)分别插入PM1的I1a位和PM2的I2a位进行比较。
我们使用了一个组合启动子-5‘-UTR复合体PUTR4来驱动荧光蛋白的表达,该复合体在所测试的天然大肠杆菌上游转录调控序列中表现出最好的性能。
此外,在PM1质粒中引入了卡那霉素抗性盒(KanR),并将安普霉素抗性盒(APRR)插入到PM2中以提供抗性选择标记;这两个插入位点都不包括在任何已知蛋白质的编码区(图2a)。
将I1a-PUTR4-GFP、I1a-PUTR4-sfGFP、I2a-PUTR4-GFP和I2a-PUTR4-sfGFP转化ECN菌株,去除了原有的pMUT质粒。
评估了每个工程ECN菌株的荧光蛋白表达强度(图2B)。
在相同条件下,sfGFP蛋白的荧光强度普遍高于GFP蛋白。
经修饰的PM2载体上的I2a位点比PM1载体上的I1a位点具有更强的荧光强度,可用于检测单个工程隐形载体表达的荧光蛋白。
当同时使用两种工程载体进行荧光表达时,其荧光值高于只含有一种重组载体的菌株。
然而,这个值不是单个重组质粒菌株表达的荧光值的总和,而是总和的0.8倍(图2B)。

图2.隐藏质粒不同插入位点的鉴定。荧光蛋白表达基因在pMUT1和pMUT2中的插入位置
工程隐藏质粒在水杨酸合成中的应用水杨酸广泛用于一些经典药物的生产,如阿司匹林和拉米夫定。
从理论上讲,内源性分支酸在大肠杆菌中的转化可以通过加强两个催化反应来实现。
益生菌ECN菌株中SA的合成途径可以通过将两个功能基因(编码异分支酸合成酶的entC和编码异分支酸丙酮酸裂解酶的pchB)整合到益生菌菌株中来构建(图3A)。
此外,将益生菌设计为生产目标产品的微生物细胞工厂可能会降低随后的纯化和细胞分离的成本。
因此,以SA的生物合成为模型途径,验证了筛选出的插入位点在代谢途径工程中的可行性和实用性。

重新导入工程化隐质粒对菌株的影响
从分支酸合成芳香氨基酸的途径是SA合成中的竞争因子,因此我们首先敲除了竞争芳香氨基酸途径中的关键基因(PHEA和TyRA)(图3A)。
然后,将含有由PUTR4驱动的途径基因(entC和pchB)的共表达盒分别克隆到I1a和I2a位点。
两株产生的菌株(E05和E06)的生长没有明显的抑制作用(图3B)。
使用这两个质粒中的任何一个将两个途径基因转移到ECN工程菌株后,可以明显检测到目标产物SA(图3C)。
将基因插入到Pm1上的I1a位,经72 h发酵后,菌体产酸94.6±7.3 mg/L。
当利用PM2的I2a位携带途径基因时,在EcN06株中获得了较高的SA效价(115.0±11.7 mg/L)(图3C)。
以上结果表明,益生菌ECN菌株中的两个隐含质粒均可作为构建SA合成途径的有效载体。

图3.工程隐藏质粒在SA生产中的应用
在麦角硫蛋白合成中的应用麦角硫醚(EGT)是一种强大的抗氧化剂,能够维持细胞氧化还原动态平衡、清除ROS和螯合金属离子。
进一步选择EGT合成途径作为第二个模型来验证不同插入位点在隐藏质粒中的强度。
从理论上讲,将两个基因(ncegt1和cpegt2)导入ECN菌株可以重建从内源性组氨酸前体到产生EGT的合成途径。
然后,将ncegt1和cpegt2的基因组合分别插入到PM1的I1a位和PM2的I2a位。
E09菌株的EGT产物效价达到38.2 mg/L,E10菌株的效价达到45.0 mg/L(图5),证明了利用工程隐质粒构建功能通路的便利性。
EGT合成的基因被插入到相对较强的I2a位点,目的产物的产量高于确实插入了I1a位点的菌株。

图4. 构建的SA产生菌E07的生产稳定性

图5.隐藏质粒工程菌在EGT生产中的应用
无抗生素基因质粒代谢调控可行性利用游离质粒进行体外构建非常方便快捷,因此利用它们携带多途径基因是一种常用的策略。
然而,这一策略主要应用于实验室测试阶段。大剂量抗生素难以加入以维持遗传稳定性,缺乏耐药因子容易导致外源功能质粒丢失。
ECN菌株的两个天然隐藏质粒,为益生菌途径工程提供了更多的选择。
野生型ECN菌株中的天然隐藏质粒具有较高的复制稳定性和较低的代谢负荷。
在遗传稳定性评估中,工程ECN菌株显示出相对稳定的水杨酸生产能力,从而促进了利用益生菌开发更巧妙和高价值的遗传通路。
局部序列的折叠也可能是影响转录和表达的另一个因素,从而进一步改变转录效率。
通过额外的基因工程杀死开关的设计,工程菌株将在排泄时被有效地杀死,从而有力地防止生物遏制。
在外源基因表达中应用工程隐藏质粒显示了高拷贝表达的优势,并且避免了在生产过程中添加任何抗生素或诱导剂。
参考文献【1】益生菌菌株Nissle 1917可干扰不同肠道侵袭性病原菌对人肠道上皮细胞的侵袭
【2】粪便样品中益生菌菌株Nissle 1917菌株特异性聚合酶链式反应的建立
【3】作为疾病治疗和诊断策略的可定制药物输送系统的大肠杆菌Nissle 1917的进展
