
看新型ADC如何改变HER2阳性乳腺癌治疗格局。
根据流行病学数据显示,女性乳腺癌全球年新发病例已达230万例,约占所有新发恶性肿瘤病例的11.7%,超过肺癌成为全球发病率最高的恶性肿瘤[1]。HER2是由ERBB2编码的一种跨膜酪氨酸激酶受体,可控制细胞的正常生长。在肿瘤细胞中,HER2变异可导致肿瘤细胞增殖、侵袭及转移。自1987年首次发现HER2作为重要的驱动基因与乳腺癌密切相关,至今HER2阳性乳腺癌已成为一种独立的分子分型,抗HER2靶向治疗是其标准治疗模式。
随着抗HER2药物的不断进展,HER2阳性乳腺癌历经化疗、大分子单克隆抗体和小分子TKI,逐步进入ADC药物时代,患者的生存时间和生活质量得以显著提升。但这类治疗仍存在一定局限性,包括二线治疗的中位PFS仅1年左右[2,3]、多数患者仍面临原发性或继发性耐药以及脑转移高发且预后更差。因此,亟需开放新型抗HER2治疗药物进一步满足这些未尽之需。
DESTINY-Breast03研究中,T-DXd组的中位PFS达到了28.8个月,而T-DM1组仅为6.8个月[4],自此,T-DXd树立了HER2阳性晚期乳腺癌的二线治疗的新标准。2023年2月24日,T-DXd获得国家药品监督管理局(NMPA)正式批准,本品单药适用于治疗既往接受过一种或一种以上抗HER2药物治疗的不可切除或转移性HER2阳性成人乳腺癌患者。医学界肿瘤频道特邀中山大学附属肿瘤医院王树森教授对T-DXd的机制和重磅研究数据进行解读,并分享对T-DXd进入中国乳腺癌临床实践的期待和展望。
优化设计和创新机制,是突破性获益的基础
T-DXd是依托DXd-ADC平台研发的第一款新型ADC药物,优化的结构设计和创新作用机制使其发挥了更强效的抗肿瘤作用。T-DXd具备ADC药物的基本特性,即兼具传统化疗药物的细胞毒性以及靶向治疗药物的肿瘤特异性,能够更精准地与肿瘤细胞相结合,扩大治疗窗,对肿瘤细胞产生更强杀伤作用。
T-DXd由靶向HER2单抗(与曲妥珠单抗具有相同氨基酸序列)、高活性拓扑异构酶Ⅰ抑制剂DXd和可裂解连接子组成[5]。DXd的抗肿瘤活性是SN38(伊立替康活性代谢产物)的10倍,约为传统化疗药物的1000倍,且与乳腺癌常用化疗药物以及以抗微管类药物作为载药的其他HER2靶向ADC药物的作用机制不同,能有效避免交叉耐药。基于四肽的连接子有效降低了整体ADC药物的疏水性,使得T-DXd即使携带约8个载药(即药物抗体比DAR约为8)也能保持稳定性,从而不影响代谢速率,突破了部分传统ADC药物DAR为2-4的限制。不仅如此,基于连接子可裂解、DAR高达8、DXd的膜通透性,T-DXd可发挥强效旁观者效应[6],能穿透细胞膜进入临近的肿瘤细胞,不仅能进一步增强疗效,还使其抗肿瘤作用不局限于HER2高表达的肿瘤,对HER2低表达及HER2异质性肿瘤依旧有效。

图1 ADC药物在体内发挥抗肿瘤作用的过程[6]
从DB01、DB02到DB03研究,看T-DXd疗效全面升维
DESTINY-Breast01(DB01)研究是一项在既往接受过T-DM1治疗的HER2阳性晚期不可切除或转移性乳腺癌成人患者中开展的Ⅱ期、单臂研究,该研究结果多次荣登国际大会,并且在2020年2月发表于《新英格兰医学杂志》(NEJM)杂志。2021 年ESMO大会中公布的最新研究结果显示,在既往中位治疗达6线的情况下,客观缓解率(ORR)达到62%,中位持续缓解时间(DOR)为18.2个月,中位无进展生存期(PFS)和中位总生存期(OS)分别为19.4个月和29.1个月[7]。
基于该数据,FDA附条件加速批准了T-DXd用于转移阶段既往已接受过≥2线抗HER2治疗的HER2阳性晚期乳腺癌的适应症。但DB01是单臂II期研究,需进行随机对照的Ⅲ期临床研究对该适应症人群的疗效及安全性进行验证,DESTINY-Breast02(DB02)研究应运而生。

图2 DB01研究的PFS和OS[7]
DB02研究入组患者的既往中位治疗线数为3线,几乎所有患者既往均接受过曲妥珠单抗和T-DM1治疗,近80%的患者接受过帕妥珠单抗治疗。研究显示[8],T-DXd组中位PFS显著延长(17.8个月 vs 6.9个月),相比TPC组降低疾病进展或死亡风险64%。并且,T-DXd组在治疗24个月时有42.2%的患者仍未发生疾病进展,而TPC组仅13.9%。两组中位OS分别为39.2个月和26.5个月,T-DXd组相比TPC组显著延长12.7个月,降低患者死亡风险34%。在安全性方面,与既往研究报道的基本一致,T-DXd的不良反应以1-2级的消化道、血液学以及乏力、脱发等一般性不良反应为主,TPC组以腹泻、恶心和手足综合征等为主。T-DXd组药物相关的间质性肺炎发生率为10.4%,绝大部分为1-2级,3-5级发生率为1.2%。Ⅲ期研究DB02证实了T-DXd相比曲妥珠单抗或拉帕替尼联合卡培他滨的优效性,进一步验证了T-DXd在HER2阳性晚期乳腺癌的卓越疗效。
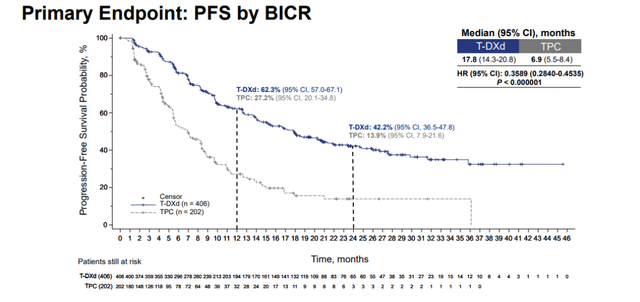
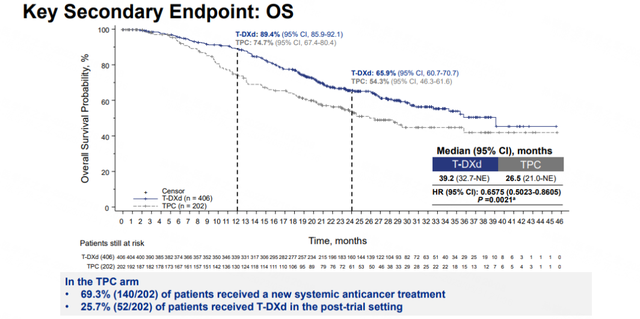
图3 DB02研究的PFS和OS[8]
DESTINY-Breast03(DB03)研究则与T-DM1进行了头对头比较[4],截至2022年7月25日,T-DXd组中位PFS达到28.8个月,是T-DM1组(6.8个月)的4.2倍。并且,T-DXd组相比T-DM1组还可显著延长OS,降低死亡风险36%(HR=0.62,95%Cl 0.47-0.87)。两组的ORR分别为78.5%和35%,其中T-DXd组的CR率高达21.1%,中位DoR达到36.6个月,这意味着有相当一部分患者可以获得深度缓解并可能长期维持疾病不进展。两组的安全性与此前研究中报道的基本一致,T-DXd组的ILD发生率为15.2%,但大多为1-2级,无4级或5级ILD事件发生,提示T-DXd的使用安全可控。
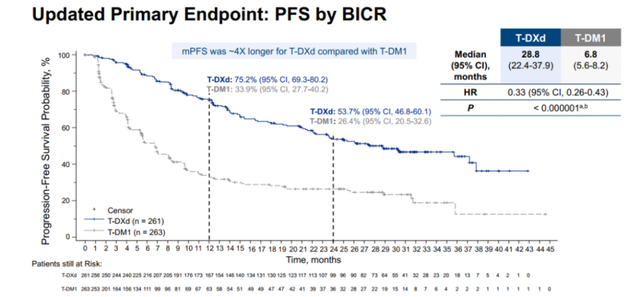

图4 DB03研究的PFS和OS[4]
正是基于T-DXd的显著获益,目前,《中国临床肿瘤学会(CSCO)乳腺癌诊疗指南(2023)》[9]、《中国抗癌协会乳腺癌诊治指南与规范(2022精编版)》[10]、《ESMO转移性乳腺癌的诊断、分期和治疗指南(2023)》[11]、《NCCN乳腺癌诊疗2023 v1》[12]、《ABC6第六届晚期乳腺癌国际共识会议》[13]以及《ASCO HER2阳性晚期乳腺癌系统治疗指南(2022)》[14]六大国内外指南一致推荐T-DXd作为HER2阳性晚期乳腺癌二线治疗方案。
T-DXd实现后线至二线的全覆盖,推动乳腺癌诊疗升维
晚期乳腺癌虽难以治愈,但应用新型治疗药物、优化治疗模式等方法可以帮助患者缓解临床症状,改善生活质量,T-DXd以其优化结构和创新机制为基础,为患者带来长期带瘤生存的新希望。随着T-DXd在中国的成功获批,无疑为我国乳腺癌临床实践开启了ADC时代的新篇章。
基于DB01、DB02和DB03研究的结果,T-DXd已实现HER2阳性晚期乳腺癌后线到二线的全覆盖。但从具体的获益数据上看,随着T-DXd治疗线数前移,其疗效得以全面提升。可能与前线治疗时患者身体状况更佳,对于药物的耐受更好有关,提示在患者身体状态更优的情况下使用更强效药物能够最大化其生存获益。因此在临床实践中,建议在二线治疗阶段启动T-DXd,从而带来最优获益。
但我国乳腺癌患者基数大,各地的医疗资源存在一定的不均衡,患者治疗经历不尽相同,多线治疗情况较为复杂,面对这样的国情,临床医生在选择治疗时也要适当灵活变通。基于T-DXd在DB系列研究中的颠覆性疗效获益,推荐T-DXd作为二线治疗优选。同时,T-DXd在后线使用的循证依据充分,如果既往未接受过T-DXd的治疗,三线及后线治疗仍可继续选择。
T-DXd实现后线至二线全覆盖,无疑为更好地应对我国晚期乳腺癌临床实践的复杂情况提供了新的治疗方案,期待T-DXd进入临床后能够为我国乳腺癌患者带来更充分的获益,也期待随着T-DXd中国临床应用经验的不断积累以及相应研究的不断深入,使得乳腺癌临床实践模式进一步优化,从而推动我国乳腺癌诊疗水平的全面提升。
专家简介 王树森 教授
王树森 教授中山大学附属肿瘤医院 乳腺癌单病种首席专家
教授、主任医师、博士生导师
学术兼职:
中国研究型医院协会乳腺癌专业委员会副主任委员
中国抗癌协会肿瘤内分泌专委会副主任委员
中国临床肿瘤协会(CSCO)乳腺癌专家委员会副主任委员
中国抗癌协会乳腺癌专业委员会常务委员
广东省抗癌协会化疗专业委员会主任委员
广东省癌症中心乳腺癌诊疗质量控制专家委员会主任委员
广东省胸部肿瘤防治研究会乳腺癌专业委员会主任委员
广东省抗癌协会乳腺癌专业委员会副主任委员
广东省南方肿瘤临床研究协会乳腺癌专委会副主委委员
广东省医师协会乳腺专科工作委员会副主任委员
参考文献
[1]Sung H, et al. Global Cancer Statistics 2020:GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries.CA Cancer J Clin.2021 May;71(3):209-249.
[2]Xu B, et al. Pyrotinib plus capecitabine versus lapatinib plus capecitabine for the treatment of HER2-positive metastatic breast cancer (PHOEBE): a multicentre, open-label, randomised, controlled, phase 3 trial. Lancet Oncol. 2021 Mar;22(3):351-360.
[3]Verma S, et al. Trastuzumab emtansine for HER2-positive advanced breast cancer. N Engl J Med. 2012;367:1783–91
[4]Hurvitz SA, et al. Trastuzumab deruxtecan versus trastuzumab emtansine in patients with HER2-positive metastatic breast cancer: Updated results of the randomized, phase 3 study DESTINY-Breast03. 2022 SABCS. GS2-02.
[5]Ogitani Y, et al. DS-8201a, a novel HER2-targeting ADC with a novel DNA topoisomerase I inhibitor, demonstrates a promising antitumor efficacy with differentiation from T-DM1. Clin Cancer Res. 2016;22(20):5097–5108.
[6]Yu J, et al. Antibody-Drug Conjugates Targeting the Human Epidermal Growth Factor Receptor Family in Cancers. Front Mol Biosci. 2022 Feb 28;9:847835
[7]Saura C, et al.Trastuzumab Deruxtecan (T-DXd)in Patients with HER2-Positive Metastatic Breast Cancer: Updated Survival Results from a Phase 2 Trial (DESTINY-Breast01).2021 ESMO. 279P.
[8]Krop I, Park YH, Kim SB, et al. Trastuzumab deruxtecan vs physician’s choice in patients with HER2+ unresectable and/or metastatic breast cancer previously treated with trastuzumab emtansine: primary results of the randomized, phase 3 study DESTINY-Breast02. 2022 SABCS. GS2-01.
[9]中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)乳腺癌诊疗指南2022版.
[10]中国看该协会乳腺癌专业委员会. 中国抗癌协会乳腺癌诊治指南与规范(2022精编版)
[11]Gennari A, et al. ESMO Clinical Practice Guideline for the diagnosis, staging and treatment of patients with metastatic breast cancer. Ann Oncol. 2021 Dec;32(12):1475-1495.
[12]National Comprehensive Cancer Network (NCCN). Breast cancer guidelines. 2023.v1.
[13]Advanced Breast Cancer Sixth International Consensus Conference. 4-6 November 2021.
[14]Giordano SH, et al. Systemic Therapy for Advanced Human Epidermal Growth Factor Receptor 2-Positive Breast Cancer: ASCO Guideline Update. J Clin Oncol. 2022 May 31:JCO2200519
* 此文仅用于向医学人士提供科学信息,不代表本平台观点

