
基因编辑是一种通过精确修改基因组序列以诱导基因组插入、缺失或碱基替换的技术。
成簇规律间隔短回文重复序列(CRISPR)/CRISPR 相关蛋白(Cas)系统是目前应用最广泛的基因组编辑技术,利用具有核酸内切酶功能的Cas蛋白如 Cas9和Cas12a等,用于位点特异性靶向DNA识别和切割。
随着2023年12月FDA批准首款CRISPR/Cas9基因编辑疗法Casgevy(exagamglogene autotemcel,exa-cel)上市,CRISPR基因组编辑技术才真正的从科学走进应用。
那么CRISPR基因组编辑技术是什么呢?它有哪些广泛的应用?面临的挑战有哪些?下面一一展开揭晓。

01
CRISPR基因组编辑的分子原理
迄今为止,基因编辑技术主要经历了以下三代的发展:第一代:锌指核酸酶(ZFNs);第二代:转录激活因子样效应核酸酶(TALENs);第三代:CRISPR/ Cas系统基因编辑技术[1,2]当CRISPR/Cas系统结合靶标后,核酸酶催化DNA切割,产生DNA双链断裂(DSB),通过细胞DNA修复途径进行DSB修复导致基因修饰(编辑)的引入。
细胞DNA修复途径主要包括:1. 末端连接通路导致短插入或缺失(插入缺失);2. 同源定向修复(HDR)使用外源DNA修复模板用于设计精确的修改(图1)[3]。
源自化脓性链球菌的典型 Cas9 蛋白(SpCas9)是第一个被重新用于基因组编辑的Cas核酸酶,由于其固有的高活性和特异性,仍然是使用最广泛的基因编辑器。
Cas12a是一种源自V型 CRISPR-Cas 系统的Cas核酸酶,在Cas9几年后被发现,同样被重新用于基因组编辑。
Cas9是由CRISPR RNA(crRNA)反式激活 CRISPR RNA(tracrRNA)对或单向导 RNA(sgRNA)组成的双向导 RNA,而 Cas12a 仅有crRNA。
靶 DNA 的识别取决于与向导 RNA 的间隔序列的互补性以及原间隔区相邻基序(PAM)的存在。Cas9 识别 NGG PAM,而 Cas12a 需要 TTTV PAM(V = G、C 或 A)(图1)[3]。
 图1. CRISPR基因组编辑的分子原理
图1. CRISPR基因组编辑的分子原理02
CRISPR基因组编辑的局限性以及解决方案
CRISPR-Cas系统作为简单有效的可编程基因编辑工具的重新利用极大地推动了许多领域的基础和应用研究,为靶向基因疗法和各种生物技术应用的发展奠定了基础。
然而,高度进化的生物防御系统的功能特征与精确基因组编辑工具所期望的功能不同。因此,第一代基于CRISPR的基因编辑工具的应用潜力受到几个关键因素的限制,主要包括特异性、靶向范围、需要依赖内源性DSB修复机制来实现基因组编辑以及CRISPR组件的递送受到递送载体、靶细胞或器官组织的限制等(图2)。
针对这些限制,研究人员采取特定的技术解决方案:
a.特异性:通过开发高保真核酸酶变体、化学修饰的向导 RNA 和基因组编辑器核酸酶的受控表达,解决了基因组编辑器的脱靶活性;
b.靶向范围:SpCas9的NGG PAM序列要求限制了可靶向基因组位点的范围。使用具有替代或放宽PAM要求的Cas9工程变体、具有替代PAM要求的其他天然衍生的Cas9直系同源物和Cas12a酶来解决这个问题;
c.编辑结果的控制:已经开发了各种方法,包括不对称或系留 HDR 修复模板、细胞周期同步和 NHEJ 抑制剂,以提高 HDR 的效率并通过末端连接途径抑制插入缺失的形成。第二代技术(如Base or Prime editing)能够独立于 HDR 引入精确修改。
d.递送:将基因组编辑器组分稳定运输到细胞中需要载体,载体的技术得到了很大的发展,电穿孔/核传染、脂质纳米颗粒和病毒载体促进了基因组编辑器组分的细胞递送。
 图2.CRISPR基因组编辑的局限性
图2.CRISPR基因组编辑的局限性03
CRISPR编辑技术的发展
由于CRISPR编辑技术的局限性,尤其是对 DSB 的遗传毒性的担忧以及解决 HDR 效率低下的必要性进一步促进了第二代CRISPR技术的发展,该技术介导基因组编辑,而无需依赖于 DBS 形成和 HDR,如单碱基编辑器(Base editors, BEs)、引导编辑(Prime Editor,PE )、转录调节CRISPRi 和 CRISPRa以及RNA 编辑技术(图3)。
3.1 单碱基编辑器(Base editors, BEs)单碱基编辑器采用了Cas9切口酶(nCas9)与核碱基修饰酶融合技术,由可编程的DNA结合蛋白组成,如dCas 核酸酶或转录激活物样效应物(TALE)重复阵列,融合脱氨酶,将一个碱基转换为另一个碱基,而无需双链断裂。
这种方法对于引入特定的点突变(A-to-G或C-to-T,以及A-to-C或C-to-G)特别有效,从而实现精确的基因校正或引入终止密码子以进行精确的基因敲除。
 图3.当前的CRISPR编辑技术3.2 引导编辑(Prime Editor,PE)
图3.当前的CRISPR编辑技术3.2 引导编辑(Prime Editor,PE)引导编辑(Prime Editor,PE)有一个引导编辑器(PE)蛋白,通常是一个切口酶Cas9 (nCas9)和逆转录酶(RT)的融合,以及一个引导Prime Editor的RNA (pegRNA),pegRNA中包含single guide RNAs (sgRNAs),在其3′-端还有一段引物结合序列(Primer binding site,PBS)和转录模板序列(RT template),它定位编辑目标位点,在不引入双链断裂(DSB)和供体DNA模板的前提下,实现靶标位点的插入、删除和替换多达几十个核苷酸的序列(图4)[4]。
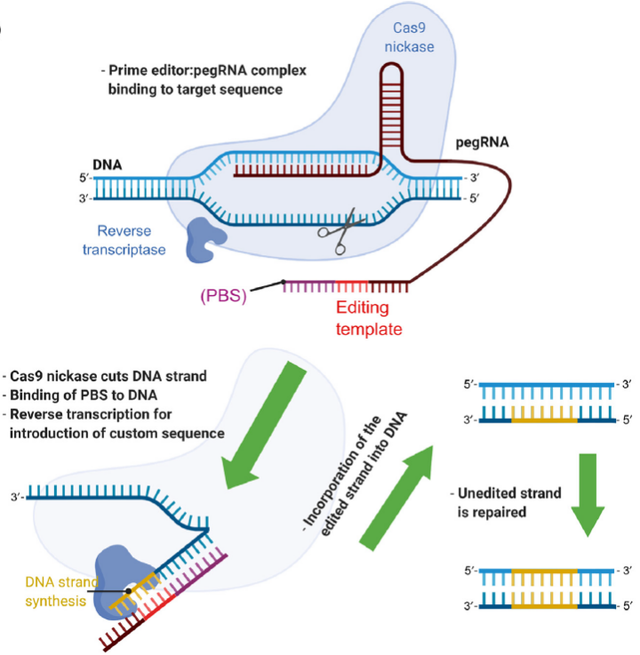 图4. 引导编辑(PE)作用机制3.3 转录调节CRISPRi 和 CRISPRa
图4. 引导编辑(PE)作用机制3.3 转录调节CRISPRi 和 CRISPRaCRISPR技术不仅适用于基因组编辑,而且还能够对基因表达进行瞬时操作,如CRISPR干扰(CRISPRi)和 CRISPR激活(CRISPRa)转录调节技术,通过靶向失活的Cas9(dCas9)与转录调节结构域(如 VP64 或 KRAB)融合到基因启动子实现RNA引导的基因转录控制。
Cas9的催化失活突变体最初用于细菌靶向基因启动子和空间阻断RNA聚合酶,从而抑制RNA转录。
在真核细胞中抑制基因表达,核酸酶失活的Cas9可以融合到各种转录和表观遗传调节剂,例如KRAB转录阻遏蛋白结构域,以及靶向启动活跃转录基因的区域。
由此产生的方法被称为CRISPRi,可以有效地敲低基因表达,作为基于小干扰RNA(siRNA)的RNA干扰的替代品。
CRISPRa是通过融合dCas9 到反式激活结构域,例如 VP64 及其衍生物实现。类似地,核酸酶死亡的Cas9蛋白融合可用于激活特定基因的表达,通过直接募集转录激活因子或调节染色质状态。
3.4 RNA 编辑技术与基因组编辑不同,RNA 编辑技术利用靶向RNA的Cas13核酸酶,用于靶向转录本降解(当具有催化活性时)或用于转录本编辑(当催化失活并融合到腺苷脱氨酶时)。
04
CRISPR基因组编辑技术
在基础研究和人类医学中的应用
CRISPR 技术通过允许科学家在各种实验模型中模拟致病突变改变了基因研究,创建大规模的全基因组筛选方法,并开发合成基因记录设备,用于研究正常发育和疾病进展。
CRISPR基因组编辑从基础研究和新疗法的的技术进步给促进人类健康带来了许多具有巨大潜力的应用(图5),主要包括以下几种:
a.CRISPR诱导的基因敲除或突变:CRISPR 核酸酶、碱基编辑器和引物编辑器有助于产生特定的基因改变,包括培养细胞系和动物中的基因敲除、敲除和靶向突变,从而能够对人类遗传疾病变异进行建模。
b.CRISPR筛选:这些应用涉及使用向导RNA文库进行高通量基因功能分析。用这些文库转导的细胞进行基于选择的测定,下一代测序用于分析细胞群中引导RNA的富集或耗竭,从而鉴定参与特定生物过程的基因。CRISPR 筛选可以使用 CRISPR 核酸酶、CRISPRi/a 转录调节剂以及碱基和引物编辑器进行。
c.体外治疗性基因编辑:这些治疗方法涉及在受控的实验室环境中对来自患者或健康供体的细胞进行CRISPR编辑,然后将修饰的细胞(重新)引入患者体内。
d.体内治疗性基因组编辑:与体外策略相比,体内治疗性基因编辑涉及通过局部或全身递送将 CRISPR 基因组编辑器直接施用于体内受影响的组织,靶向特定器官或组织,通常使用基于脂质纳米颗粒或病毒载体的方法。
许多原理验证临床前研究已经成功地证明了体内的治疗性基因组编辑,特别是在杜氏肌营养不良症动物模型中通过肌肉定向递送 AAV9载体Cas9 和 guide RNA恢复抗肌萎缩蛋白蛋白表达的努力,并在小鼠模型中通过AAV9介导将CBE递送至大脑挽救脊髓性肌萎缩症。
 图5. CRISPR基因组编辑技术的应用
图5. CRISPR基因组编辑技术的应用05
基因组编辑领域的新兴技术
在过去十年中,当前CRISPR技术的局限性变得越来越明显,新的方法和策略继续被开发和微调,以解决这些限制,并提高基于CRISPR的基因组编辑的功效和多功能性。
5.1 紧凑型 RNA 引导核酸酶这些新兴的第三代工具和技术(图6)包括近期发现的紧凑型 RNA 引导核酸酶,这些核酸酶已适用于基于 DSB 的编辑,也可以用于其他基因组编辑器模式(如BE和 PE)的RNA引导的DNA结合平台。
5.2 CRISPR引导重组酶和转座子CRISPR引导重组酶和转座子的发展显示出潜力,基于逆转录转座子和用于编辑RNA转录本基因组编辑技术也出现了新的方法,如DNA聚合酶编辑器、工程化CRISPR整合酶、靶标引发的逆转录、表观遗传学编辑器和基因编辑中的人工智能等。
● DNA聚合酶编辑器:该技术将Cas9切口酶与DNA聚合酶相结合,并结合单链DNA模板,例如使用HUH核酸内切酶。与引导编辑(PE)的一个关键区别在于它使用DNA聚合酶而不是逆转录酶,以及在反式中递送DNA模板。
● CRISPR相关转座子:这些天然存在的移动遗传元件利用CRISPR效应复合物与转座酶蛋白结合进行RNA引导的转座,将长DNA序列插入特定的基因组位点。
● 工程化CRISPR整合酶:这些技术基于将引导编辑与位点特异性丝氨酸重组酶相结合。引导编辑最初在靶 DNA 位置引入重组酶 att 位点,随后重组酶催化大 DNA 有效载荷的插入。
● 靶标引发的逆转录:该过程涉及将切口酶Cas9与非长末端重复序列(非LTR)逆转录转座子衍生的逆转录酶和RNA融合。它通过切开靶 DNA 来产生游离 3’端到逆转录转座子相关 RNA 的引物逆转录上,从而导致靶向 DNA 插入。
● 表观遗传学编辑器:将失活的dCas9与DNA甲基化酶和组蛋白修饰酶融合,可在特定基因组位置进行靶向染色质修饰,从而在不改变潜在DNA序列的情况下实现基因表达的遗传性抑制(CRISPR off)。基因再激活(CRISPR on)涉及使用Cas9 与 DNA 去甲基化酶和转录激活因子结构域的融合来靶向被抑制的基因。
● 基因编辑中的人工智能:人工智能在从头蛋白质和指南设计以及脱靶位点和编辑结果的计算预测方面取得了重大进展。
 图6. 基因组编辑领域的新兴技术
图6. 基因组编辑领域的新兴技术写在最后
基因组编辑技术历经几代的发展,目前CRISPR/Cas系统是应用最广泛的,尽管CRISPR基因组编辑存在局限性,但是它的未来是光明的。它不仅有可能推动研究突破和彻底改变人类医学,而且还有可能加强农业和解决生态问题,从而为子孙后代创造更健康、更可持续的未来奠定基础。
参考文献
1.Wood, A.J., Lo, T.W., Zeitler, B., Pickle, C.S., Ralston, E.J., Lee, A.H., Amora, R., Miller, J.C., Leung, E., Meng, X., et al. (2011). Targeted Genome Editing Across Species Using ZFNs and TALENs. Science 333, 307.
2.Doudna, J.A., and Charpentier, E. (2014). Genome editing. The new frontier of genome engineering with CRISPR-Cas9. Science 346, 1258096.
3.Martin Pacesa, Oana Pelea, and Martin Jinek, Past, present, and future of CRISPR genome editing technologies, Cell 187, February 29, 2024
4.Marek Marzec, Goetz Hensel, Prime Editing: Game Changer for Modifying Plant Genomes, Trends Plant Sci. 2020 Aug;25(8):722-724.
