近期,诺华制药每年仅需两针*的靶向PCSK9(前蛋白转化酶枯草溶菌素9)小干扰RNA(siRNA)英克司兰钠注射液(商品名:乐可为)亚洲区域动脉粥样硬化性心血管疾病(ASCVD)或ASCVD高危人群中III期临床研究(ORION-18研究[1])中国大陆地区亚组结果发表在期刊《中华循环杂志》上。


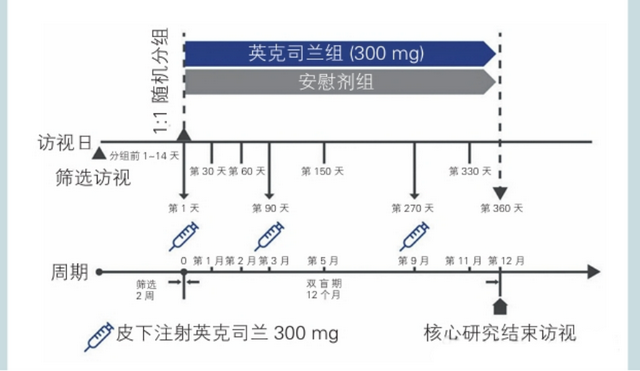
ORION-18研究(NCT04765657)是一项评估英克司兰在亚洲患者(中国大陆、中国台湾、韩国和新加坡)中有效性和安全性的多中心、随机、双盲、安慰剂对照Ⅲ期临床试验,中国大陆亚组纳入232例已接受饮食控制和最大耐受剂量他汀类药物治疗(联合或不联合其他降脂治疗)但LDL-C仍升高的ASCVD患者或ASCVD高危患者。
患者1:1随机在第1天、第90天、第270天接受英克司兰300mg(n=116)或安慰剂(n=116)治疗。
主要终点:LDL-C从基线至第330天的百分比变化。
次要终点包括:LDL-C从第90天至第360天经时间校正的百分比变化和绝对值变化;LDL-C从基线至第330天的绝对值变化;PCSK9、总胆固醇、载脂蛋白B(ApoB)、非高密度脂蛋白胆固醇(non-HDL-C)从基线至第330天的百分比变化。
第330天达到LDL-C<1.8mmol/L、LDL-C较基线降低≥50%、达到所处ASCVD风险水平总体降脂目标(LDL-C总体目标值:ASCVD患者<1.4mmol/L,ASCVD高危人群<1.8mmol/L)的受试者比例。安全性终点为治疗期间出现的不良事件、实验室检查异常、严重不良事件及其严重程度和其与治疗的相关性。
中国大陆区域患者研究流程和基线特征如下:


研究主要终点中国大陆亚组结果为,主要终点英克司兰组LDL-C基线至第330天经安慰剂校正百分比变化均值-61.16%,绝对值变化均值-1.73mmol/L,P均<0.0001.
第330天,英克司兰组和安慰剂组LDL-C<1.8mmol/L患者比例分别为79.6%(74/93)和7.8%(6/77),LDL-C较基线降幅≥50%患者比例分别为69.9%(65/93)和0%(0/77),达到总体降脂目标患者比例分别为66.7%(62/93)和2.6%(2/77)。

研究次要终点中国大陆亚组结果如下:

安全性方面,为期12个月双盲治疗期间,英克司兰组和安慰剂组报告至少1次TEAE受试者比例分别为78.4%(91/116)和69.8%(81/116),大多数为轻度至中度,英克司兰组和安慰剂组报告至少1次治疗相关TEAE的受试者比例比例分别为14.7%(17/116)和13.8%(16/116)。
英克司兰组和安慰剂组报告至少1次严重不良事件受试者比例分别为19.0%(22/116)和11.2%(13/116)。英克司兰组最常见的治疗相关TEAE(至少2例,发生率≥1.7%)为肝功能异常(1.7%)和体重增加(1.7%),安慰剂组为血肌酸激酶升高(3.4%)、黄疸(1.7%)、血胆红素升高(1.7%)、γ-谷氨酰转移酶升高(1.7%)和糖尿病(1.7%)。两组均未发生与治疗相关的严重不良事件。英克司兰组有1例受试者因急性心肌梗死死亡,研究者认为与治疗无关。注射部位的所有TEAE均为轻度,且为一过性。
英克司兰作为全球首款用于降低LDL-C的靶向PCSK9 siRNA,作用机制是基于生物体内天然的RNA干扰机制,并利用N-乙酰半乳糖胺(GalNAc)靶向递送至肝细胞,从上游精准靶向降解肝脏PCSK9 mRNA,从而阻断PCSK9蛋白合成,进而使肝细胞表面LDL受体水平增加,降低血液LDL-C水平[2]。值得强调的是,RNA干扰仅发生于细胞质中,小干扰RNA药物并非基因药物,不会影响原有DNA序列或其他基因表达。
英克司兰于2020年12月获欧洲药品管理局(EMA)批准,用于治疗成人高胆固醇血症或混合性血脂异常。2021年12月获美国食品药品监督管理局(FDA)批准。
2023年8月获得国家药品监督管理局(NMPA)批准上市,作为饮食的辅助疗法,用于成人原发性高胆固醇血症(杂合子型家族性和非家族性)或混合型血脂异常患者的治疗,包含:在接受最大耐受剂量的他汀类药物治疗仍无法达到LDL-C目标的患者中,与他汀类药物、或者与他汀类药物及其他降脂疗法联合用药,以及在他汀类药物不耐受或禁忌使用的患者中,单独用药或与其他降脂疗法联合用药。
*英克司兰首针后第3个月需注射第2针,随后每半年一针。
参考文献:
[1] 霍勇, 李勇, 韩雅君, 等. 英克司兰治疗亚洲动脉粥样硬化性心血管疾病患者或高危人群的疗效与安全性:ORION-18研究中国大陆亚组分析. 中国循环杂志, 2025, 40(2): 124-130.
[2] 赵紫楠, 史琛, 胡欣, 等.小干扰RNA降脂药物药学专家共识[J/OL].中国医院药学杂志, 2023;1-11.
审批码LEQ0042801-93834,有效期为2025-03-26至2026-03-25,资料过期,视同作废
