再生医学作为新兴领域,通过激活人体自身修复机制,在组织再生、疼痛缓解及功能改善方面展现出巨大潜力。此前,美国疼痛与神经科学学会(ASPN)专家组发布《再生医学治疗慢性疼痛临床实践指南》,系统评估了包括间充质干细胞(MSCs)和外泌体在内的生物制剂在慢性疼痛管理中的证据等级与临床应用建议。本文聚焦指南中MSCs与外泌体的核心内容,结合临床案例进行解读。

国际指南更新:再生医学为慢性疼痛提供新方案
ASPN指南明确将可注射生物制剂(如富血小板血浆、骨髓浓缩物、脂肪衍生生物制剂、间充质干细胞及外泌体等)列为慢性疼痛的推荐治疗选项。证据表明,对于骨关节炎、椎间盘退变、神经性疼痛等特定适应症,此类疗法在缓解疼痛、改善功能及生活质量方面优于传统治疗或安慰剂。然而,指南同时强调需进一步开展高质量临床试验,以优化制备标准、剂量方案及疗效比较。
1
间充质干细胞:慢性疼痛管理的多面手
间充质干细胞(MSCs)是一种多能干细胞,广泛存在于人体的骨髓、脂肪、脐带等组织中。它们具有强大的自我更新能力和分化潜能,可以分化为多种细胞类型,如骨细胞、软骨细胞和脂肪细胞。
间充质干细胞具有多向分化潜能与免疫调节特性,其通过分泌血管生成素(AngI/AngII)、骨形态发生蛋白(BMP)、脑源性神经营养因子(BDNF)等活性分子,促进组织修复并抑制炎症反应,为慢性疼痛治疗提供新路径。

临床案例:骨关节炎疼痛显著缓解
一项随机对照试验纳入24例骨关节炎患者进行6个月随访比较,实验组(12例)接受单次关节腔内注射1×10⁸自体MSCs,对照组(12例)注射生理盐水。
结果提示,经由单次往关节腔内注射间充质干细胞后,实验组6个月时WOMAC评分显著改善。对照组6个月时WOMAC评分则无显著变化。随访期间两组均未观察到严重不良事件。在MRI上,实验组在6个月时软骨缺损没有显著变化,而对照组的缺损增加。该临床研究表明,关节内注射自体间充质干细胞为骨关节炎患者提供了令人满意的功能改善和疼痛缓解。

2
外泌体:精准调控疼痛的“细胞信使”
外泌体,这一源自间充质干细胞的小型囊泡物质,这些囊泡的直径通常介于30至150纳米之间,由间充质干细胞释放而出。它们内部富含各类生物活性分子,包括蛋白质、脂质以及RNA等,扮演着细胞间信息传递的关键角色。
外泌体可调控炎症反应,减轻炎症因子对神经末梢的刺激,从而缓解疼痛。研究发现,间充质干细胞来源的外泌体能够抑制促炎细胞因子的释放,促进抗炎细胞因子的表达,有效减轻炎症性疼痛。另外,外泌体还能调节神经病理性疼痛相关的信号通路,降低神经元的兴奋性,减少疼痛信号的传递。与传统治疗手段相比,外泌体具有低免疫原性、良好的生物相容性和靶向性等优势,有望成为慢性疼痛治疗的新策略。
临床案例1:逆转椎间盘退变,改善腰痛

针对椎间盘退变(IVDD)引发的慢性腰痛,研究发现如果将间充质干细胞外泌体添加到从退化椎间盘获得的培养的髓核细胞中的时候,就会导致退化椎间盘重建为正常的髓核细胞表型,这表明了其的再生能力以及在缓解腰部慢性疼痛方面的强大潜力。
临床案例2:缓解神经性疼痛
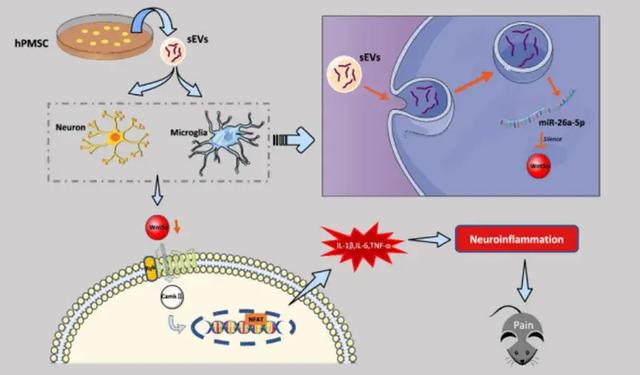
动物实验表明,MSCs外泌体通过递送TGF-β、IL-10及miR-26a-5p等抗炎因子,有效抑制神经损伤部位的过度免疫反应,加速神经功能恢复,为糖尿病性神经痛、带状疱疹后神经痛等难治性疼痛提供新思路。
ASPN指南的发布标志着再生医学在疼痛管理领域迈入新阶段。随着技术迭代与临床证据积累,MSCs及外泌体有望突破传统治疗瓶颈,为慢性疼痛患者提供更安全、持久的解决方案。未来,跨学科合作与创新技术融合将是推动这一领域发展的核心动力。
参考资料:
[1]D'Souza RS,, Vardhan S, Eshraghi Y, Javed S, Abdullah NM, Christo PJ, Diwan S, Hassett LC, Sayed D, Deer TR. Evidence-Based Clinical Practice Guidelines on Regenerative Medicine Treatment for Chronic Pain: A Consensus Report from a Multispecialty Working Group. J Pain Res. 2024 Sep 11;17:2951-3001. doi: 10.2147/JPR.S480559. PMID: 39282657; PMCID: PMC11402349.
链接:https://pubmed.ncbi.nlm.nih.gov/39282657/
[2] Fayazi, N., Sheykhhasan, M., Soleimani Asl, S. et al. Stem Cell-Derived Exosomes: a New Strategy of Neurodegenerative Disease Treatment. Mol Neurobiol 58, 3494–3514 (2021).
链接:https://doi.org/10.1007/s12035-021-02324-x
[3] Zhang X, Hu Y, Hao D, Li T, Jia Y, Hu W, Xu Z. New strategies for the treatment of intervertebral disc degeneration: cell, exosome, gene, and tissue engineering. Am J Transl Res. 2022 Nov 15;14(11):8031-8048. PMID: 36505274; PMCID: PMC9730054.
链接:https://pmc.ncbi.nlm.nih.gov/articles/PMC9730054/
[4]Lee WS, Kim HJ, Kim KI, Kim GB, Jin W. Intra-Articular Injection of Autologous Adipose Tissue-Derived Mesenchymal Stem Cells for the Treatment of Knee Osteoarthritis: A Phase IIb, Randomized, Placebo-Controlled Clinical Trial. Stem Cells Transl Med. 2019 Jun;8(6):504-511. doi: 10.1002/sctm.18-0122IF: 6.0 Q1 . Epub 2019 Mar 5. PMID: 30835956; PMCID: PMC6525553.
链接:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6525553/
[5]Lu Y, Zhang J, Zeng F, Wang P, Guo X, Wang H, Qin Z, Tao T. Human PMSCs-derived small extracellular vesicles alleviate neuropathic pain through miR-26a-5p/Wnt5a in SNI mice model. J Neuroinflammation. 2022 Sep 7;19(1):221. doi: 10.1186/s12974-022-02578-9. PMID: 36071475; PMCID: PMC9450435.
链接:https://pmc.ncbi.nlm.nih.gov/articles/PMC9450435/
