欧盟《MDR过渡期时间表》提出:2024年5月26日,不满足新过渡期应用条件的遗留器械的过渡期结束。

从过渡期延长中受益所需满足的条件有:
·2024年5月26日:提交MDR符合性评估申请并建立MDR质量管理体系的截止日期;
·2024年9月26日:与公告机构签署书面协议并将适当的监督转移至MDR公告机构(如适用)的截止日期;
·器械继续遵守先前适用的欧盟法规(MDD/ AIMDD);
·设计或预期目的无重大变化;
·器械不会对健康或安全构成不可接受的风险。
↘ 遗留器械的定义
·在2021年5月26日前,MDD指令下的I类医疗器械已拟订符合性声明,MDR法规下其符合性评估程序需要公告机构参与的;
·在2021年5月26日前,按照MDD指令或AIMDD指令已取得CE标志。
↘MDR法规对质量管理体系的要求
按照MDR要求,制造商需要基于MDR要求建立、运行并保持质量管理体系。
2024年5月26日前,所有遗留器械的质量体系建设必须符合MDR下EN ISO 13485:2016。
针对遗留器械,MDR法规新增许多质量体系要求:包括上市后监督、市场监督、警戒系统、经济运营商和器械登记等,对此制造商最晚不迟于2024年5月26日已建立质量管理体系。

·第44家:RISE Medical Notified Body AB(公告机构号:3033),瑞典第2家MDR公告机构。
·第45家:TÜV SÜD Danmark(公告机构号:2443),丹麦第1家、TÜV南德第2家MDR公告机构。
·第46家:AFNOR Certification法标认证(公告机构号:0333),法国第2家MDR公告机构。
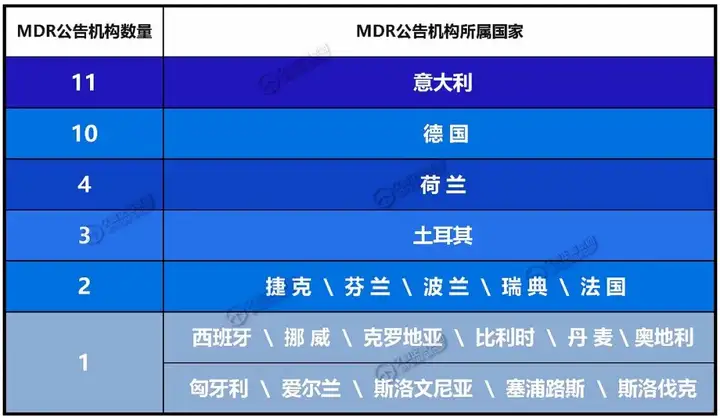
·第47家:MTIC InterCert S.r.l.(公告机构号:0068),意大利第11家MDR公告机构,这使得意大利成为拥有最多MDR公告机构的国家。
·第48家:Kiwa Belgelendirme Hizmetleri A.Ş.(公告机构号:1984),Kiwa旗下第3家、土耳其(非欧盟国家)第3家MDR公告机构。
·第49家:QMD Services GmbH(公告机构号:2962),奥地利第1家MDR公告机构。
最新的MDR公告机构所在国家分布↘
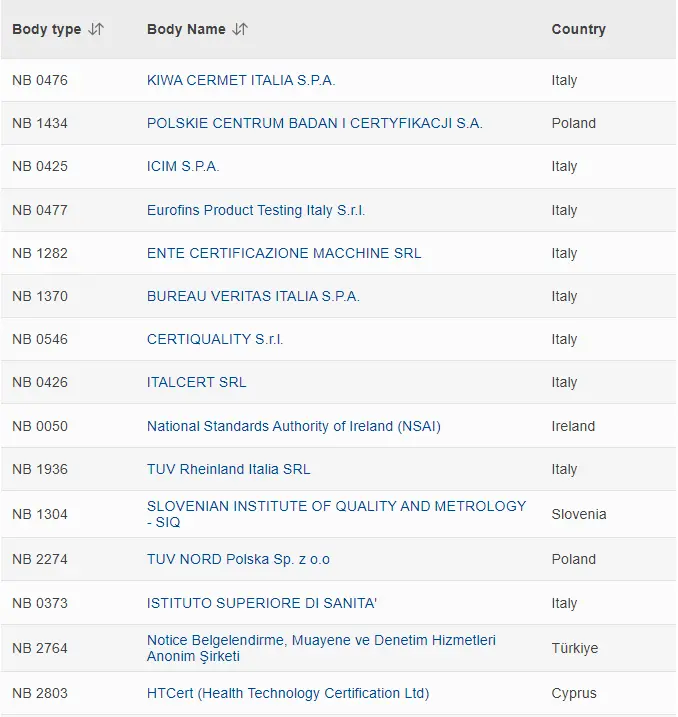
全新的完整版MDR公告机构名单↘


*MDR公告机构惊人地高速新增,是为何?
MDR/IVDR申请曾面临公告机构资源匮乏导致超85%申请被拒的问题,2024年以来欧盟快速增加6家MDR公告机构,展示欧盟加码发力解决公告机构审核资源不足的坚决性,也向制造商宣告:尽快放心提交MDR CE申请,公告机构审核资源足以承接认证申请。
3.公布《欧盟MDR申请调查结果》调查数据截止时间:2024年2月29日。
·申请提交与证书颁发的数量
解读:已提交20424份MDR申请,颁发6978份MDR证书;相比2023年10月:MDR申请增加2578份、增幅14%;MDR证书增加1379份、增幅25%。
·MDR申请提交与签约数量的增长
解读:与2023年3月相比,提交申请数量增长73%,书面协议签署数量增长55%。
·MDR申请提交至签约的耗时
解读:从提交申请至签署书面协议的平均时间间隔为1-2个月,在占比62%的大多数情况下,从提交申请至签署书面协议需要少于2个月的时间。
·MDR申请被拒绝的原因
解读:共有454份申请被拒绝,被拒原因中占比最高(55%)为“不在公告机构的指定范围内”,其次为“申请不完整”(占比17%),之后占比由高到低依次为“错误的产品鉴定/设备分类”、“其他原因”、“错误的符合性评估程序”、“公告机构资源不足”。
·MDR公告机构颁发新证书所需的时间
解读:77%为13个月及以上;40%为13-18个月;21%为19-24个月;19%为6-12个月;16%为24个月及以上;5%为少于6个月。
