
引言
在药物开发过程中,临床试验的高失败率是一个长期存在的挑战。尽管大量的药物发现项目启动,最终能通过临床试验并获得批准的药物寥寥无几。已有研究表明,具有强基因证据支持的治疗假说可以显著提高试验的成功率。然而,仍有许多试验在达到终点之前被终止,揭示这些试验失败背后的具体原因对于未来减少试验失败率至关重要。自2007年以来,美国食品药品监督管理局(FDA)要求将临床试验结果提交至ClinicalTrials.gov,这是一个免费访问的全球数据库,旨在登记临床研究和结果。在这些被终止的试验中,停止的原因通常以自由文本的形式记录下来,包括终止(termination)、暂停(suspension)或撤回(withdrawal)。此前的一项研究对3,125个被终止的试验原因进行了分类,发现仅有10.8%的试验因明确的负面结果而停止,大多数(54.5%)试验因患者招募不足或其他业务或行政原因而终止。7月29日Nature Genetics的研究报道“Genetic factors associated with reasons for clinical trial stoppage”,进一步扩展了这一工作,研究人员训练了一个自然语言处理(NLP)模型,对28,561个被终止的试验进行分类,并结合开放目标平台(Open Targets Platform)的数据,分析基因证据与试验终止原因之间的关系。研究发现,如果缺乏来自人类群体或基因修饰动物模型的强基因证据,试验更可能因缺乏疗效而终止。此外,如果药物靶基因在人类群体中高度受限或广泛表达于各组织,试验因安全原因终止的概率也更高。药物发现过程中,失败仍然是最常见的结果,且失败的原因多种多样,可能涉及药物靶点选择、药物递送、药代动力学、毒理学等多个方面。通过系统地评估临床试验的终止原因,可以更好地理解试验失败的多重因素,并改进药物开发过程中的决策质量。该研究的重要性在于,它不仅揭示了临床试验失败的原因,还强调了基因证据在药物开发中的关键作用。未来,通过进一步扩展对失败试验的记录和分析,可以全面了解试验失败的多重原因,从而提高药物开发的成功率和效率。继续利用人类基因学证据,可以帮助药物研发团队更好地选择和验证治疗靶点,降低试验失败的风险。 在药物开发过程中,临床试验的高失败率是一个长期存在的挑战。虽然有许多药物发现项目启动,但能够完全通过临床试验并最终获得批准的药物寥寥无几。已有研究表明,具有强基因证据支持的治疗假说可以显著提高试验的成功率。然而,仍有许多试验在达到终点之前被终止,揭示这些试验失败背后的具体原因对于未来减少试验失败率至关重要。在该研究中,研究团队进一步扩展了这一工作,训练了一个自然语言处理(NLP)模型,对28,561个被终止的试验进行分类,并结合开放目标平台(Open Targets Platform)的数据,分析基因证据与试验终止原因之间的关系。数据收集:从ClinicalTrials.gov数据库中收集截止到2021年11月27日的所有停止的临床试验数据,共计28,561项试验。数据包括试验终止的自由文本理由。训练NLP模型:为了对试验终止的原因进行分类,研究团队训练了一个基于BERT模型的NLP分类器。BERT(Bidirectional Encoder Representations from Transformers)是一种深度双向转换器表示的语言理解模型。模型的训练数据包括先前手动分类的3,124个停止试验的数据,并扩展了新的分类标准,包括17种停止原因和6个不同的高级结果类别。模型验证:为了验证模型的准确性,研究团队还手动注释了额外的1,675个停止原因,从而扩展了训练集。然后,模型对28,561个试验进行了分类。基因证据整合:将分类结果与开放目标平台中的基因证据数据进行整合,评估基因证据与试验终止原因之间的关系。开放目标平台提供了与药物靶点和疾病相关的综合基因证据。
在药物开发过程中,临床试验的高失败率是一个长期存在的挑战。虽然有许多药物发现项目启动,但能够完全通过临床试验并最终获得批准的药物寥寥无几。已有研究表明,具有强基因证据支持的治疗假说可以显著提高试验的成功率。然而,仍有许多试验在达到终点之前被终止,揭示这些试验失败背后的具体原因对于未来减少试验失败率至关重要。在该研究中,研究团队进一步扩展了这一工作,训练了一个自然语言处理(NLP)模型,对28,561个被终止的试验进行分类,并结合开放目标平台(Open Targets Platform)的数据,分析基因证据与试验终止原因之间的关系。数据收集:从ClinicalTrials.gov数据库中收集截止到2021年11月27日的所有停止的临床试验数据,共计28,561项试验。数据包括试验终止的自由文本理由。训练NLP模型:为了对试验终止的原因进行分类,研究团队训练了一个基于BERT模型的NLP分类器。BERT(Bidirectional Encoder Representations from Transformers)是一种深度双向转换器表示的语言理解模型。模型的训练数据包括先前手动分类的3,124个停止试验的数据,并扩展了新的分类标准,包括17种停止原因和6个不同的高级结果类别。模型验证:为了验证模型的准确性,研究团队还手动注释了额外的1,675个停止原因,从而扩展了训练集。然后,模型对28,561个试验进行了分类。基因证据整合:将分类结果与开放目标平台中的基因证据数据进行整合,评估基因证据与试验终止原因之间的关系。开放目标平台提供了与药物靶点和疾病相关的综合基因证据。
在药物开发过程中,临床试验停止的多种原因和分布特征(Credit: Nature Genetics)
停止原因分类:图中对28,561项临床试验停止的原因进行了分类,共有15种具体的停止原因和6个不同的高级结果类别。最常见的停止原因:图中显示“患者招募不足”是最常见的停止原因,占所有停止原因的36.67%。这表明在试验设计和执行过程中,患者招募是一个主要挑战。安全或副作用问题:共有977项试验(占3.38%)因安全或副作用问题被停止。这些试验大多集中在试验的早期阶段。负面结果:2,197项试验(占7.6%)因负面结果(如疗效不足或无价值)被停止。负面结果在第二阶段(Phase II)和第三阶段(Phase III)的试验中更为常见。停止原因与临床阶段的关系:图中还展示了不同临床阶段的试验停止原因的分布。例如,第二阶段和第三阶段的试验更可能因负面结果被停止,而第一阶段的试验更可能因安全或副作用问题被停止。治疗领域的分布:图中显示了不同治疗领域的试验停止原因的分布。肿瘤学试验占所有停止试验的48%,且更容易因安全或副作用问题被停止。研究结果显示,缺乏强有力的基因证据的试验更可能因为缺乏疗效而终止。在没有人类群体基因数据或基因修饰动物模型支持的情况下,试验更易遭遇失败。此外,如果药物靶基因在人类群体中高度受限或广泛表达于各组织,试验因安全原因终止的概率也更高。疗效不足:研究发现,缺乏强基因证据支持的试验更可能因疗效不足而终止。具体来说,缺乏人类基因组关联研究(GWAS)数据支持的试验,其终止的概率显著增加(OR=0.61,P=6×10^-18)。安全问题:在肿瘤学领域,如果药物靶基因在人类群体中高度受限,试验更容易因安全问题终止(OR=2.14,P=8.1×10^-79)。这种情况在基因功能高度保守的基因中尤为明显。患者招募不足:患者招募不足是试验终止的另一个主要原因,占所有试验终止原因的36.67%。这表明,在试验设计阶段需要更多的考虑和计划,以确保足够的患者参与试验。业务或行政原因:有一部分试验因业务或行政原因终止,这类原因与试验的治疗假说无直接关系,但仍然对试验的顺利进行产生了重大影响。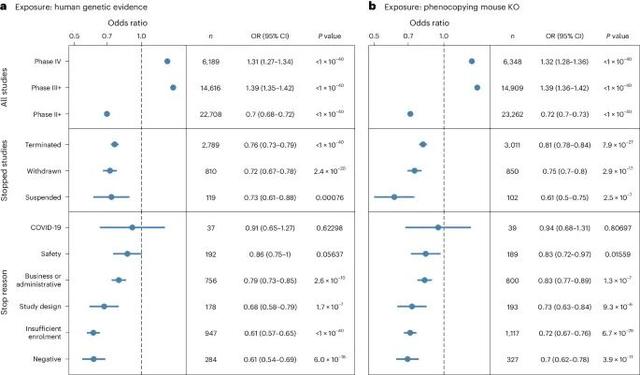
基因证据在预测临床试验结果方面的重要性(Credit: Nature Genetics)
基因证据与试验成功率的关联:图中展示了在不同临床阶段、不同停止原因类别以及整体临床试验中,基因证据的可用性如何影响试验的结果。总体结果:图中显示,具有基因证据支持的临床试验更有可能成功推进至后续阶段。在所有临床试验中,具有基因证据支持的试验更有可能取得成功(OR=1.39,P<1×10^-40)。停止的试验中,基因证据的支持显著减少(OR=0.7,P<1×10^-40)。按停止原因分类:负面结果(如疗效不足或无价值):这些试验中,基因证据的支持显著减少(OR=0.61,P=6×10^-18)。患者招募不足:这些试验也表现出基因证据支持的减少(OR=0.72,P=2.4×10^-20)。设计问题和业务或行政原因:这些试验的基因证据支持也较弱(OR分别为0.79和0.86)。按临床阶段分类:第二阶段(Phase II)及以后:具有基因证据支持的试验更有可能成功(OR=1.31,P<1×10^-40)。第三阶段(Phase III)及以后:具有基因证据支持的试验成功率更高(OR=1.32,P<1×10^-40)。小鼠模型的支持:图中还展示了小鼠敲除模型对人类疾病表型的支持情况。结果表明,在基因证据定义为小鼠模型中药物靶点同源基因敲除导致类似疾病表型的情况下,试验失败的风险较低(OR=0.7,P=4×10^-11)。不同停止原因下的基因证据影响:负面结果和安全问题的试验表现出最弱的基因证据支持,而因患者招募不足、设计问题或业务原因停止的试验也显示出基因证据支持的减少。研究还发现:在所有停止的试验中,3.38%的试验因安全或副作用问题终止,7.6%的试验因负面原因(如疗效不足或无价值)终止。在肿瘤学领域,药物靶基因在人类群体中的限制性表达与试验因安全问题终止有显著关联。基因证据在评估药物靶点和疾病之间的关联中具有重要作用,可以显著提高试验的成功率。
不同治疗领域和靶点基因特性对临床试验因安全或副作用问题终止风险的影响(Credit: Nature Genetics)
不同治疗领域的安全风险:肿瘤学:肿瘤学试验因安全或副作用问题而终止的风险显著增加(OR=2.14, P=8.1×10^-79)。这是因为肿瘤学试验通常涉及新型和高风险的治疗方法,这些方法可能带来较高的安全性挑战。非肿瘤学:在非肿瘤学领域,因安全或副作用问题终止的风险相对较低。靶点基因的遗传限制(genetic constraint):高度受限的基因:研究发现,如果靶点基因在人类群体中高度受限(GnomAD pLOEUF 16th percentile),试验因安全问题终止的风险增加了1.5倍(OR=1.473, P=1.0×10^-22)。这表明基因受限程度越高,其变异可能导致的副作用越严重。基因功能丧失不耐受(LoF-intolerant):如果靶点基因被分类为功能丧失不耐受(pLI>0.9),试验因安全问题终止的风险增加了1.4倍(OR=1.367, P=4.8×10^-15)。基因表达的组织特异性:低组织特异性基因:基因在多种组织中表达的情况下,试验因安全问题终止的风险增加(OR=1.3, P=2.1×10^-7)。这种基因在人体中广泛表达,可能导致更多的非预期副作用。组织特异性表达基因:相对来说,靶点基因在特定组织中表达的试验,其因安全问题终止的风险较低(OR=0.8, P=1.8×10^-4)。靶点基因的网络连接性:高网络连接性:靶点基因与多个其他基因相互作用(至少10个合作伙伴)的试验,其因安全问题终止的风险增加。这表明靶点基因的复杂相互作用网络可能增加试验的安全性挑战。临床试验的高失败率给药物开发带来了巨大挑战,研究人员不断探索如何提高试验的成功率。基因证据在这一过程中扮演了重要角色。该研究通过系统地分析临床试验的终止原因,揭示了基因证据在提高试验成功率方面的重要性。基因证据的价值:基因证据能够为药物靶点的选择提供重要支持,帮助研究人员预测药物的疗效和安全性。在药物开发的早期阶段,结合基因证据可以显著降低试验失败的风险,提高试验的成功率。数据整合与分析:利用NLP技术对大量临床试验数据进行分类和分析,可以更全面地理解试验失败的多种原因。这种方法不仅提高了数据分析的效率,还为未来的研究提供了宝贵的参考。临床试验设计:在设计临床试验时,研究人员需要考虑多种因素,包括患者招募、试验地点、药物剂量等。基因证据的应用可以帮助研究人员更好地设计试验,提高试验的科学性和可行性。该研究通过应用自然语言处理技术和基因证据数据,对临床试验的终止原因进行了系统分析,揭示了基因证据在提高试验成功率方面的重要性。研究结果表明,具有强基因证据支持的治疗假说能够显著降低试验因疗效不足和安全问题终止的风险。未来,通过进一步扩展对失败试验的记录和分析,我们可以更全面地了解试验失败的多种原因,从而改进药物开发过程中的决策质量和成功率。基因证据的应用不仅有助于药物靶点的选择和验证,还可以提高临床试验的设计质量和科学性,为药物开发带来新的突破。参考文献
Razuvayevskaya O, Lopez I, Dunham I, Ochoa D. Genetic factors associated with reasons for clinical trial stoppage. Nat Genet. 2024 Jul 29. doi: 10.1038/s41588-024-01854-z. Epub ahead of print. PMID: 39075208.https://www.nature.com/articles/s41588-024-01854-z责编|探索君
排版|探索君
转载请注明来源于【生物探索】
End
