2025年第二季度,哪些重磅抗肿瘤新药会在国内获批上市?根据 Insight 数据库「中国上市策略& 时长预测」模块,2025 年第二季度预计将有11 款抗肿瘤新药有望首次在国内获批。本文将一一进行分享(以下排名不分先后),仅供读者参阅。
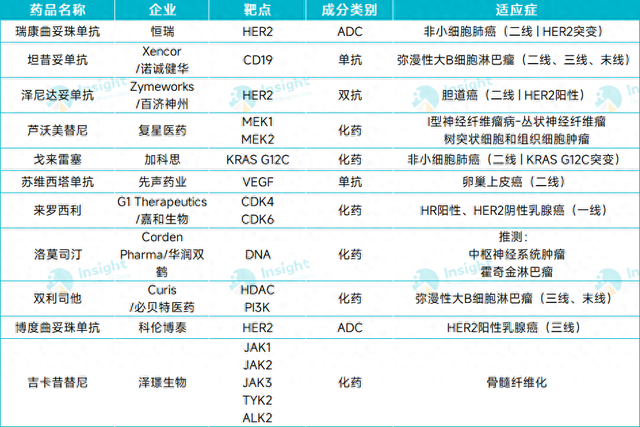
截图来源:Insight 数据库整理

恒瑞 瑞康曲妥珠单抗
HER2 ADC
2024 年 9 月 14 日,恒瑞自主研发的 HER2 ADC 瑞康曲妥珠单抗上市申请获受理,用于既往接受过至少一种系统治疗的局部晚期或转移性 HER2 突变成人非小细胞肺癌(NSCLC)患者的治疗。该申请已被 CDE 纳入优先审评。
值得一提的是,这也是国内 NSCLC 领域首个报上市的国产 HER2 ADC。
瑞康曲妥珠单抗由曲妥珠单抗、可裂解多肽连接子、以及 Exatecan 衍生物 SHR9265 组成,可特异性结合肿瘤细胞表面上的 HER2,通过组织蛋白酶水解释放游离毒素,从而抑制 DNA 拓扑异构酶 I 的活性,最终诱导肿瘤细胞的凋亡。
2025 年 2 月,瑞康曲妥珠单抗单药用于既往经治 HER2 突变晚期 NSCLC 患者的 II 期 HORIZON-Lung 临床研究的主要结果发表于《The Lancet Oncology》。结果显示,该药是首个在 HER2 突变 NSCLC 人群中证实有效性和安全性的国产 ADC,有望为该人群提供更优的治疗选择。
瑞康曲妥珠单抗目前已开展多项 I-III 期临床研究,涵盖 HER2 表达或突变的晚期胃癌或胃食管结合部腺癌、结直肠癌、晚期非小细胞肺癌、早期或晚期乳腺癌、胆道癌、妇科恶性肿瘤等。
诺诚健华 坦昔妥单抗
CD19 单抗
2024 年 6 月 21 日,诺诚健华 CD19 单抗坦昔妥单抗(Tafasitamab)联合来那度胺治疗不适合自体干细胞移植条件的复发/难治弥漫性大 B 细胞淋巴瘤(DLBCL)成人患者的上市许可申请获受理,并纳入优先审评。
坦昔妥单抗是一款靶向 CD19 的 Fc 结构域优化的人源化单克隆抗体,可通过细胞凋亡和免疫效应机制介导 B 细胞肿瘤的裂解。坦昔妥单抗的权益是几经周转:
最初由 MorphoSys 公司在 2010 年从 Xencor 公司获得全球独家开发和商业化权利。2020 年 1 月,MorphoSys 和 Incyte 签署了在全球开发和商业化坦昔妥单抗的合作及许可协议,并在 2024 年 2 月达成新协议,授予 Incyte 全球范围内独家开发和商业化权利。2021 年 8 月,诺诚健华与 Incyte 达成合作和许可协议,以 3500 万美元首付款及至多 8250 万美元潜在开发、注册和商业化里程碑付款,以及分级销售分成,获得坦昔妥单抗在大中华区的血液瘤和实体瘤开发及独家商业化权利。百济神州 泽尼达妥单抗
HER2 双抗
2024 年 6 月 7 日,百济神州的 HER2 双抗泽尼达妥单抗上市申请获受理,用于既往接受过全身治疗的 HER2 高表达的不可切除局部晚期或转移性胆道癌患者。该申请已被纳入优先审评。
泽尼达妥单抗最初由 Zymeworks 开发。2018 年,百济神州通过一项 4.3 亿美元的合作,获得了该药和另一款双抗 ADC 在亚洲(日本除外)、澳大利亚和新西兰的独家权益。
2024 年 11 月,泽尼达妥单抗获得美国 FDA 加速批准上市,用于治疗经治、不可切除、局部晚期或转移性 HER2 阳性胆道癌患者。Insight 数据库显示,这是全球首个且唯一一个获批用于 HER2+ 胆道癌的 HER2 双抗。
该药关键性 IIb 期 HERIZON-BTC-01 研究的积极结果于 2023 ASCO 年会上公开亮相。研究结果显示,在 HER2 阳性胆道癌患者中,cORR 为 41%,中位 DOR 为 12.9 个月。百济神州在 2024 年 ASCO 年会上更新了其近 2 年的随访数据,中位 OS 为 15.5 个月,中位 DOR 为 14.9 个月。
复星医药 芦沃美替尼
MEK1/2 选择性抑制剂
2024 年 5 月和 6 月,复星医药创新药芦沃美替尼 (FCN-159) 有两项适应症先后在国内报上市,分别用于:治疗成人树突状细胞和组织细胞肿瘤;以及用于治疗 2 岁及 2 岁以上儿童 1 型神经纤维瘤病 (NF1) 相关的丛状神经纤维瘤(PN)。这两个适应症均已被纳入优先审评。
芦沃美替尼为 MEK1/2 选择性抑制剂,拟主要用于晚期实体瘤、I型神经纤维瘤、树突状细胞和组织细胞肿瘤、低级别脑胶质瘤等的治疗。
除了神经纤维瘤病和组织细胞增生症以外,该新药还被用于治疗低级别脑胶质瘤、动静脉畸形、儿童朗格汉斯细胞组织细胞增生症,于中国境内均处于 II 期临床试验阶段。
加科思 戈来雷塞
KRAS G12C 抑制剂
2024 年 5 月 22 日,加科思的戈来雷塞上市申请获受理并纳入优先审评程序,用于治疗二线及以上带有 KRAS G12C 突变的晚期或转移性 NSCLC 患者。
2025 年 1 月,加科思首次在《Nature Medicine》上公开戈来雷塞治疗 KRAS G12C 突变的二线以及上肺癌患者的完整数据。
数据显示,在单药二线 NSCLC 患者中,戈来雷塞确认客观缓解率(ORR)为 47.9%,中位无进展生存期(mPFS)为 8.2 个月,中位总生存期(mOS)为 13.6 个月。
从安全性数据来看,戈来雷塞有良好的安全性特征,和其他 KRAS G12C 抑制剂相比,具有良好的消化道安全性特征。
戈来雷塞是一种高活性、具有选择性及口服的靶向突变体 KRAS G12C 蛋白的小分子。目前已经启动多项针对晚期实体瘤患者的临床试验,包括与 SHP2 抑制剂 JAB-3312 联用治疗非小细胞肺癌,与西妥昔单抗在结直肠癌的联合用药,以及单药治疗胰腺癌的注册性临床研究。
先声药业 苏维西塔单抗
VEGF 单抗
2024 年 3 月 16 日,先声药业 1 类新药苏维西塔单抗上市申请获受理,拟联合化疗用于含铂化疗治疗失败的复发性卵巢癌、输卵管癌或原发性腹膜癌的治疗。
苏维西塔单抗是新一代重组人源化抗 VEGF 兔源单克隆抗体,可选择性地与人 VEGF 结合并阻断其生物活性,减少肿瘤血管的生成并抑制肿瘤生长,在临床前模型及早期临床研究中展现出良好的抗肿瘤活性和可控的安全性。
在 2024 年 ASCO 大会上,一项苏维西塔单抗治疗铂类化疗耐药卵巢癌的多中心、随机、双盲、安慰剂对照 III 期 SCORES 临床试验(NCT04908787)的积极结果被公布。
数据显示,苏维西塔单抗联合化疗对比安慰剂联合化疗,BIRC 评估的 PFS 分别为 5.49 个月 vs 2.73 个月,中位 OS 为 16.07 个月 vs 14.88 个月,包括研究者评估的 PFS、研究者和 BIRC 评估的疾病控制率(DCR)及缓解持续时间(DOR)等,苏维西塔单抗联合化疗组也都呈现了一致的获益趋势。
嘉和生物 来罗西利
CDK4/6 抑制剂
2024 年 3 月 13 日,嘉和生物罗西利片用于与氟维司群联用治疗既往接受内分泌治疗后疾病进展的激素受体阳性、人表皮生长因子受体 2阴性(HR+/HER2-)局部晚期或转移性乳腺癌的新药上市许可申请获受理。
来罗西利是由嘉和生物和美国 G1 Therapeutics 共同开发的一款用于治疗乳腺癌的高选择性口服型 CDK4/6 抑制剂。嘉和生物于 2020 年 6 月向 G1 Therapeutics 取得亚太地区(不包括日本)的专有权许可。
2025 年 1 月,一项来罗西利 III 期 LEONARDA -1 随机试验的结果发表于《Nature Communications》。这是一项随机、双盲、III 期研究,旨在评估来罗西利在既往接受内分泌治疗后疾病复发或进展的 HR+/HER2- 晚期或转移性乳腺癌患者中的疗效和安全性。
结果显示,相比安慰剂组,来罗西利组研究者评估的 PFS 显著改善(11.07 个月 vs 5.49个月),达到预先设定的主要终点。在安全性方面,来罗西利联合氟维司群治疗的安全性非常好,不良反应得到了很好的控制。
Corden Pharma/华润双鹤 洛莫司汀
DNA 烷化剂
2024 年 2 月 6 日,Corden Pharma 和华润双鹤共同申报的洛莫司汀上市申请获受理。本次是原研药在国内的首次报上市。
洛莫司汀是一类被广泛使用的烷基化抗癌药物,脂溶性强,能通过血脑屏障,进入脑脊液,常用于脑部原发肿瘤(如成胶质细胞瘤)及继发性肿瘤的治疗。
该药最早由 BMS 研发,是一款用于霍奇金淋巴瘤和脑肿瘤的「老药」,于 1976 年获得 FDA 批准正式上市。
必贝特医药 双利司他
HDAC/PI3K 双靶点抑制剂
2023 年 10 月 9 日,必贝特医药申报的新药双利司他上市申请获受理,用于既往接受过至少两种系统治疗的复发或难治性弥漫性大 B 细胞淋巴瘤(r/r DLBCL)成人患者的治疗。该申请已获得 CDE 优先审评资格。
双利司他的上市申请是基于其关键 IIb 期临床试验的积极结果。主要研究终点由独立影像评估委员会(IRC)评估和研究者评估的 ORR 均高于与药审中心达成的附条件上市要求,且可显著延长患者的 OS。
安全性方面,治疗相关不良事件(TRAEs)主要为血液学不良反应,可在治疗周期中自愈或经药物干预后恢复,具有良好的安全性和耐受性。
双利司他是全球首个进入 NDA 申报阶段的 PI3K/HDAC 抑制剂,在抑制肿瘤信使通路核心靶点 PI3K 的同时可抑制表观遗传修饰靶点 HDAC,产生协同抗肿瘤作用,相比单靶点 PI3K 抑制剂或 HDAC 抑制剂,其在多种血液瘤及实体瘤中活性显著提高,显示出广谱抗肿瘤活性。
科伦博泰 博度曲妥珠单抗
HER2 ADC
2023 年 5 月 11 日,科伦博泰 HER2 ADC 博度曲妥珠单抗上市申请获受理,用于既往经二线及以上抗 HER2 治疗失败的 HER2 阳性不可切除的局部晚期、复发或转移性乳腺癌。
博度曲妥珠单抗是一种创新 HER2 ADC,其通过稳定酶可裂解连接子将新型 MMAF 衍生物(高细胞毒性微管蛋白抑制剂 Duo-5)与 HER2 单克隆抗体偶联,DAR 为 2。
除了 HER2 阳性乳腺癌三线治疗以外,该药还有 1 项 NDA 已获 CDE 受理,用于治疗既往至少接受过一种抗 HER2 治疗的 HER2 阳性不可切除或转移性乳腺癌成人患者。Insight 数据库预测该项 NDA 将于今年下半年获批。
泽璟生物 吉卡昔替尼
JAK/ACVR1 双抑制剂
2022 年 10 月 17 日,泽璟生物的 1 类新药吉卡昔替尼上市申请获受理,用于治疗中、高危骨髓纤维化,包括原发性骨髓纤维化(PMF)、真性红细胞增多症后骨髓纤维化(Post-PV-MF)和原发性血小板增多症后骨髓纤维化(Post-ET-MF)。
该上市申请是基于一项关键 III 期临床试验 ZGJAK016 的积极结果。结果表明吉卡昔替尼不仅在脾脏、症状和贫血方面表现出良好的获益,而且从 48 周的长期治疗中也可以看到持久的效果。
吉卡昔替尼是一种新型 JAK 和 ACVR1 双抑制剂类药物,对 Janus 激酶包括 JAK1、JAK2、JAK3 和 TYK2 具有显著的抑制作用,且对 JAK2 和 TYK2 的抑制作用最强。另外,该药还可以通过抑制激活素受体 1(ACVR1)活性,降低铁调素转录,改善铁代谢失衡,增加血红蛋白,降低骨髓纤维化患者贫血发生率和减少输血依赖。
目前,吉卡昔替尼还正在开展多项免疫炎症性疾病和纤维化疾病的临床研究,包括重症斑秃(III 期)、中重度特应性皮炎(III 期)、强直性脊柱炎(III 期)、特发性肺纤维化(II 期)、移植物抗宿主病(II 期)、中重度斑块状银屑病(II 期)。
