
引言
细菌在正常生长过程中或作为对压力的反应会释放膜囊泡(Bacterial membrane vesicles, BMVs)到环境中,这些直径为20-500 nm的BMVs充满了细菌脂质、蛋白质、核酸、代谢产物以及表面分子,并作为生物纳米穿梭体通过内吞或膜融合等途径进入宿主细胞,从而介导营养获取、基因水平转移、细胞间通讯、抵御压力等生物学过程,被定义为“零”型分泌系统。这些纳米颗粒对其装载物具有保护和浓缩作用,并且可以实现其他分泌系统难以做到的长距离递送。更为重要的是,BMVs从生物发生到货物递送的所有阶段几乎都是“可工程化的”。BMVs不仅在自然界中丰富存在,其与生俱来的非免疫原性、无毒性以及可跨越生物屏障等独特优势,也使其成为疫苗开发、药物递送以及合成生物学和生物技术应用的理想工具。目前,BMVs相关研究主要聚焦于其生物发生、载货组分以及如何调控动植物宿主细胞与病原菌之间的相互作用,对于BMVs介导细菌种间相互作用的研究在最近也有了新的进展,促进了人们对BMVs功能的认识和理解,也进一步强调BMVs作为生物穿梭载体在介导种间及跨界生物互作的重要性。
细菌与真核微藻之间的相互作用是跨界生物互作的典型代表,是微生物之间及其与环境之间相互作用的重要功能单元,在自然生态系统和工程系统中都发挥着举足轻重的作用。在各种自然生境中,细菌和微藻可以形成跨界的微生物群落,代谢产物和信息化合物的交换决定了二者之间错综复杂的关系。一方面,细菌与微藻在生长繁殖期间能够相互提供各自所需的营养物质,从而实现“双赢”的局面;另一方面,在营养限制的条件下,一些细菌通过合成和释放杀藻活性化合物引发藻细胞裂解,在控制有害藻华过程中发挥重要作用。尽管人们意识到菌-藻相互作用的重要性已有40年的历史,但由于菌-藻互作微环境的时空复杂性以及研究技术手段的限制,目前人们对菌-藻互作方式、菌-藻跨界串扰的分子背景、菌-藻互作的生物学和生态学功能等等的理论认知还十分有限。BMVs已被证明在介导生物间的相互作用中扮演着重要的角色,但是对于BMVs是否以及如何通过识别微藻生物屏障的分子通道参与菌-藻跨界串扰仍知之甚少。因此,亟需获取相关生理学证据来证明BMVs具有将功能性生物分子从细菌细胞转移至微藻细胞的能力。
近日,细胞应激生物学国家重点实验室、厦门大学生命科学学院田蕴教授和邓贤明教授合作在Science Advances上发表题为Algicidal bacteria-derived membrane vesicles as shuttles mediating cross-kingdom interactions between bacteria and algae的研究论文,首次报导了细菌膜囊泡(BMVs)作为生物穿梭体介导细菌和真核微藻之间的跨界通讯。
 该研究首先利用扫描及透射电子显微镜技术观察到杀藻细菌Chitinimonas prasina LY03在生长过程中释放出大量BMVs粘附于细胞表面。基于此,使用密度梯度离心法提取和纯化LY03-MVs并对其进行杀藻活性及杀藻谱测定,结果发现LY03-MVs对目标微藻具有杀藻活性。随后,通过对野生型菌株LY03和无色素突变菌株QY03进行比较基因组学和转录组学分析、色素生物合成关键基因TalD缺失突变株的构建以及杀藻活性物质的分离、纯化、鉴定和杀藻活性测定,结果表明菌株LY03产生的新型杀藻化合物Tambjamine LY2能被LY03-MVs选择性装载(图1)。
该研究首先利用扫描及透射电子显微镜技术观察到杀藻细菌Chitinimonas prasina LY03在生长过程中释放出大量BMVs粘附于细胞表面。基于此,使用密度梯度离心法提取和纯化LY03-MVs并对其进行杀藻活性及杀藻谱测定,结果发现LY03-MVs对目标微藻具有杀藻活性。随后,通过对野生型菌株LY03和无色素突变菌株QY03进行比较基因组学和转录组学分析、色素生物合成关键基因TalD缺失突变株的构建以及杀藻活性物质的分离、纯化、鉴定和杀藻活性测定,结果表明菌株LY03产生的新型杀藻化合物Tambjamine LY2能被LY03-MVs选择性装载(图1)。
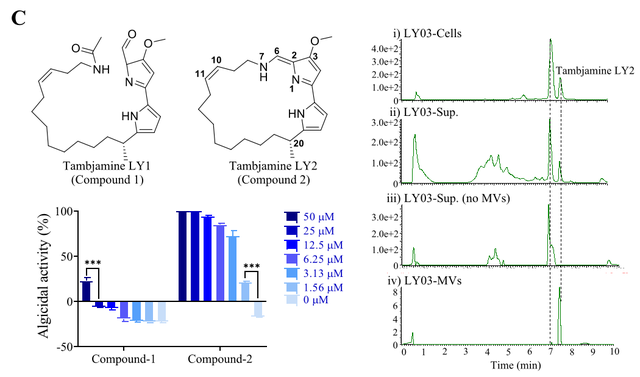
图1 LY03-MV的表征(A)、杀藻活性(B)及其对杀藻化合物的特异性装载(C)(Credit: Science Advances)
为了探索菌株LY03、LY03-MVs与目标微藻之间的相互作用,作者通过构建绿色荧光蛋白(EGFP)标记的菌株LY03(EGFP-LY03),同时使用荧光染料DIO和FM4-64分别标记LY03-MVs和微藻细胞膜,采用全自动活细胞成像系统CD7对共孵育体系进行可视化分析,观察到LY03-EGFP对目标微藻的趋化活性及其MVs对微藻细胞的粘附。荧光共定位分析结果发现了LY03-MVs与目标微藻细胞膜存在密切关联,因此进一步使用荧光探针R18结合共聚焦显微技术捕获并可视化LY03-MVs和目标微藻之间膜融合的直接证据。以上结果证明LY03-MVs可以跨越微藻细胞壁屏障与其细胞质膜发生融合,从而高效地将杀藻化合物递送至目标微藻细胞,并触发其死亡。基于LY03-MVs蛋白质谱与代谢组的分析结果,研究团队通过荧光示踪观察以及生理表型测定,证明LY03-MVs还可以封装和递送DNA和铁离子等其他货物至微藻细胞。研究发现,指数期产生的LY03-MVs可以促进缺铁假微型海链藻(Thalassiosira pseudonana)的生长,而稳定期产生的LY03-MVs则会诱导微藻细胞的裂解,表明MVs从“杀手”到“助手”的功能角色转变,可能会导致菌-藻串扰通道及其相互作用模式的变化(图2)。总的来说,以上研究结果提供了多种功能性货物通过BMVs从细菌细胞水平转移至微藻细胞的直接证据,揭示了BMVs介导的新型溶藻机制,拓宽了人们对细菌膜囊泡生物学功能的理解。基于工程化改造的BMVs有望成为一种高效、特异性的杀藻纳米材料,应用于有害藻华治理的实践中。更为重要的是,该研究还发现BMVs对货物的选择性装载能力,使其能够动态转换角色以调节菌-藻跨界互作。这为研究者打开了一扇窗,得以从独特的视角来认识和理解复杂的菌-藻互作方式,也为进一步表征甚至操控菌-藻互作提供了强有力的理论和技术支撑。
图2 BMVs介导的菌-藻跨界相互作用模式图(Credit: Science Advances)
参考文献
http://doi.org/10.1126/sciadv.adn4526责编|探索君
排版|探索君
文章来源|“BioArt”
End
