
引言
EBV(Epstein-Barr Virus)是一种人类疱疹病毒,也是首个报道的人类肿瘤病毒,全球约95%的成人经历过感染并终生携带EBV。虽然通常不产生严重症状,但EBV感染也有几率导致多种淋巴癌和上皮细胞癌,如鼻咽癌、霍奇金淋巴癌、伯基特淋巴癌、胃癌等。EBV相关癌症约占全球人类癌症负担的1.9%,每年导致约35万新增癌症病例,对人类生命健康产生巨大威胁。
潜伏期膜蛋白1(Latent Membrane Protein 1, LMP1)是EBV编码的关键致癌蛋白。1985年,Elliott Kieff课题组首次报道LMP1单一蛋白表达即能诱发B细胞的永生化,后续研究也相继发现LMP1通过模拟CD40信号参与B细胞和上皮细胞增殖和早期癌变。而与CD40不同,LMP1信号的激活不依赖任何配体,且LMP1介导的信号强度显著强于CD40。除了介导细胞转化和永生化,LMP1还参与调控多种重要生命活动,包括免疫应答(如核酸免疫通路、干扰素通路、细胞免疫等)、细胞因子和趋化因子分泌、细胞凋亡、细胞迁移、细胞互作、肿瘤侵袭和转移等。鉴于LMP1与EBV致病的高度关联性,以及LMP1在EBV相关恶性肿瘤中的广泛表达和分布,LMP1一直被认为是EBV阳性肿瘤鉴别诊断和靶向治疗的理想靶点。尽管目前对LMP1介导的下游功能有了较多认识,然而作为产生多样性功能的核心前提——即LMP1如何实现配体不依赖的组装和激活,仍然是困扰领域近40年的难题,也是影响LMP1靶向干预策略成功开发的重要阻碍。
中国科学院生物物理所高璞、高光侠、张立国合作团队经过6年多的科研攻关,揭开了EBV关键致癌蛋白LMP1自组装和组成性激活的神秘面纱,研究成果于2024年7月11日在线发表于Cell杂志——Assembly and activation of EBV latent membrane protein 1。该工作发现LMP1以一种全新且与此前猜测完全不同的机制进行寡聚自组装,并通过巧妙方式高效招募下游因子,从而激活和维持致病信号活化。另外,研究中发现的新机制和新界面,也为此前一些不清楚的现象提供了精确解释,并有望直接助力LMP1靶向干预策略的开发。

研究人员首先利用共聚焦显微镜进行细胞成像,发现LMP1在生理表达水平下会在膜上呈现为明显的聚集形态。进一步的超分辨成像表明,LMP1的聚集是一种宽度较为固定但长度不均一的细条状结构。这些结果表明LMP1可在膜上组装成有趣的聚集,但其分子层面的细节仍不清楚。为回答这一问题,研究人员计划解析LMP1在不同组装状态下的精细结构。然而,这一目标在过去近40年的研究中已被证明非常具有挑战性,主要是因为:1)性质良好的LMP1蛋白很难大量制备;2)LMP1核心跨膜区仅~20 KDa,且几乎无可识别的稳定水溶区。
经过大量尝试,研究人员解决了LMP1难表达、难纯化的问题,生化分析也提示LMP1在溶液中存在不同聚集状态。为辅助结构解析,研究人员进一步开展了系统性LMP1抗体筛选,获得了能够稳定结合LMP1跨膜区的鼠源单抗。通过抗体辅助策略,研究人员成功解析了LMP1两种意想不到的聚集态结构:轴对称二聚体和filament状高聚体。LMP1单体以一种全新的方式进行跨膜区折叠,进而通过反向平行叠合形成稳定的二聚体结构;LMP1二聚体是其进行更高级组装的基本单元,多个二聚体以“side-by-side”方式自组装形成filament状高聚结构。重要的是,这些高分辨率的结构信息,恰好符合活细胞成像所观测到的独特聚集形态,从而在不同分辨率尺度上揭示了LMP1的膜上聚集机制。
值得一提的是,由于目前PDB数据库中尚无任何LMP1的同源结构,LMP1多种状态(单体、二体及寡聚体)的真实结构均与AlphaFold2/3等软件的预测结果完全不同。而且,这种不同不仅体现在结构折叠的巨大差异,更为严重的是预测结果的基本拓扑学走向也完全错误。这提示在没有同源结构训练的情况下,我们对预测结构的使用需格外谨慎。从另一个角度来说,该研究中获得的LMP1多种聚集状态的真实结构,也为后续预测训练提供了全新且独立的折叠方式及组装模式。
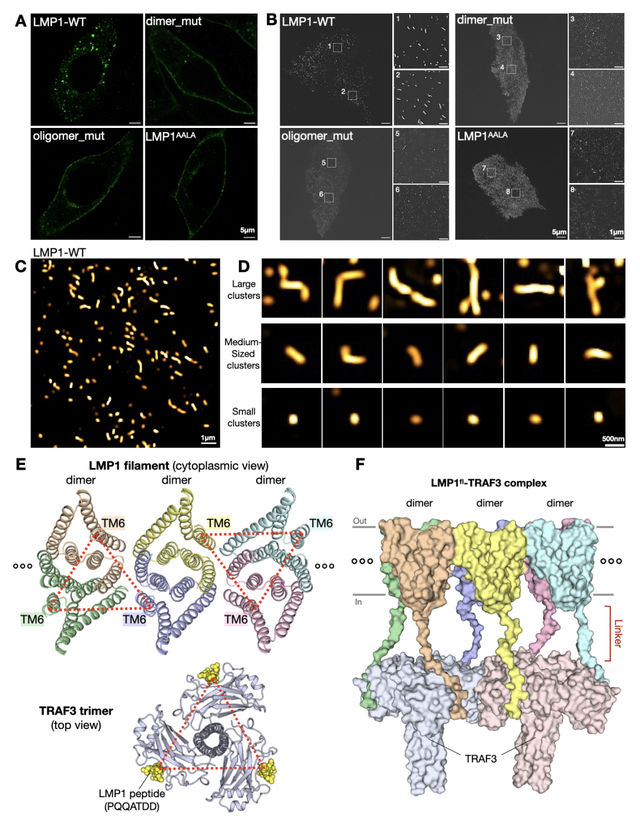
LMP1在膜上的组装和聚集(Credit: Cell)
为进一步明确LMP1的功能形式,研究人员对二聚体和寡聚体界面分别进行了系统突变,发现其均会破坏LMP1在活细胞中的膜聚集形态,且均能阻断下游信号通路活化。这既证明了LMP1分子间互作的重要性,也明确了LMP1的寡聚filament结构才是其真正的激活状态。超分辨成像结果表明,LMP1在膜上的自发filament状聚集可包含几十至数百个LMP1二聚体单元。LMP1的这种聚集在很低蛋白水平下即可发生,且随着LMP1含量增加,多聚体的数量、强度和长度均呈现显著增长。这也是首次在较低表达水平下(类似病毒感染的表达水平),系统性观察到LMP1在膜上的超分辨动态聚集和组装。
有趣的是,作为LMP1的功能相关蛋白,宿主膜受体CD40的激活需依赖其配体介导的三聚体组装;而且,LMP1和CD40共同的下游信号因子TRAF蛋白,也是以三聚体形式发挥功能。因此,长期以来领域里普遍推测LMP1也应该是采用三聚体的方式来组装,这样才能更好的与下游因子进行衔接。而LMP1却是以二聚体为单元进行“side-by-side”方式的filament自组装,那么其是如何有效协调信号转导的呢?研究人员通过细致分析,发现二聚体单元中的两个LMP1的C端,可以和邻近二聚体中一个LMP1的C端,在空间上呈现近似等边三角行的巧妙排列。由于C端延伸的水溶区负责招募下游因子,因此这种filament自组装方式,结构上等价于多个LMP1“三聚体”平行密集排列,从而能够比CD40更高效招募下游因子和进行信号转导。此前研究也证实,如果将CD40 负责下游因子招募的C端水溶区连接到LMP1的跨膜区上,那么这种嵌合体蛋白的信号激活能力要显著强于原始的CD40。同时,研究人员也通过生化手段在体外重组了LMP1与TRAF复合体,利用电镜直接观察到LMP1的filament聚集确实可以同时招募多对TRAF三聚体。LMP1这种多位点且组成性的下游蛋白招募、激活方式,极大促进了信号转导强度,并有效维系了持续的增殖、癌变信号。

CD40与LMP1的不同激活机制(Credit: Cell)
综上所述,该研究报道了EBV关键致癌蛋白LMP1自组装和组成性激活的分子基础,为EBV-LMP1诱发致癌信号和调节免疫应答等生物学功能提供了新的理论模型。另外,该研究也为开发针对EBV相关疾病的干预手段提供了新思路,例如:1)鉴于LMP1二聚和寡聚对其功能至关重要,靶向这两个全新的互作界面可能是一种有效干预策略;2)LMP1单体极小的胞外区导致其极低的免疫原性,而本研究发现的寡聚组装为LMP1胞外区抗体的开发提供了全新表位信息;3)二聚体和多聚体状态的精细结构信息,为计算和设计靶向LMP1的结合分子提供了多个潜在靶向界面。
参考文献
https://doi.org/10.1016/j.cell.2024.06.021责编|探索君
排版|探索君
文章来源|“BioArt”
End
往期精选
围观
一文读透细胞死亡(Cell Death) | 24年Cell重磅综述(长文收藏版)热文
Cell | 是什么决定了细胞的大小?热文
Nature | 2024年值得关注的七项技术热文
Nature | 自身免疫性疾病能被治愈吗?科学家们终于看到了希望热文
CRISPR技术进化史 | 24年Cell综述