
近日,《表型组学(英文)》(Phenomics)在线发表了西安交通大学第一附属医院杨刚华教授研究团队题为“Cell Function Experiments and Bioinformatics Analysis Jointly Revealed the Antineoplastic Effect of Lumican on Hepatocellular Carcinoma”的研究论文。
该研究通过生物信息学技术和细胞实验确定了LUM基因过表达对肝癌发生发展的抑制作用,揭示了LUM作为一种新的生物标志物,且预测预后和免疫反应的潜力。

论文DOI链接:https://doi.org/10.1007/s43657-024-00182-w
引用格式:Zhou, X., Xing, Z., Dong, R. et al. Cell Function Experiments and Bioinformatics Analysis Jointly Revealed the Antineoplastic Effect of Lumican on Hepatocellular Carcinoma. Phenomics (2025).https://doi.org/10.1007/s43657-024-00182-w
研究背景
肝细胞癌(HCC)是世界上最常见的癌症之一。基于免疫检查点抑制剂的疗法是目前正在研究的一种晚期HCC的全身治疗方案。肿瘤突变负荷(TMB)是指每百万碱基中检测到的体细胞基因编码错误、碱基插入、替换或缺失的总数,被认为与免疫治疗效果有关。具体来说,TMB越高,患者从免疫治疗中获得的临床获益就越好。然而,针对HCC中TMB相关基因的研究较少。因此,确定相关的可预测生物标志物,并了解它们如何影响疾病进展和治疗至关重要。
Lumican(LUM)是编码富含亮氨酸的小蛋白多糖家族II类成员的基因,主要在结缔组织中表达。据报道,LUM与多种恶性肿瘤有关,包括乳腺癌、肺癌和胃癌,这表明它可能是一种潜在的癌症生物标志物。先前的研究已经证明了LUM在肝纤维化和非酒精性脂肪性肝病中的功能,但目前尚不清楚LUM是否与HCC相关。
因此,在这项研究中,作者选取了癌症基因组图谱(TCGA)数据库中的HCC相关数据,在其TMB相关的差异表达基因(DEGs)中选择LUM作为靶基因,探讨其在HCC中的临床和免疫治疗特点以及潜在的机制,并通过实验确定了LUM在HCC中的相关功能。图1介绍了该研究的整体步骤和思路。
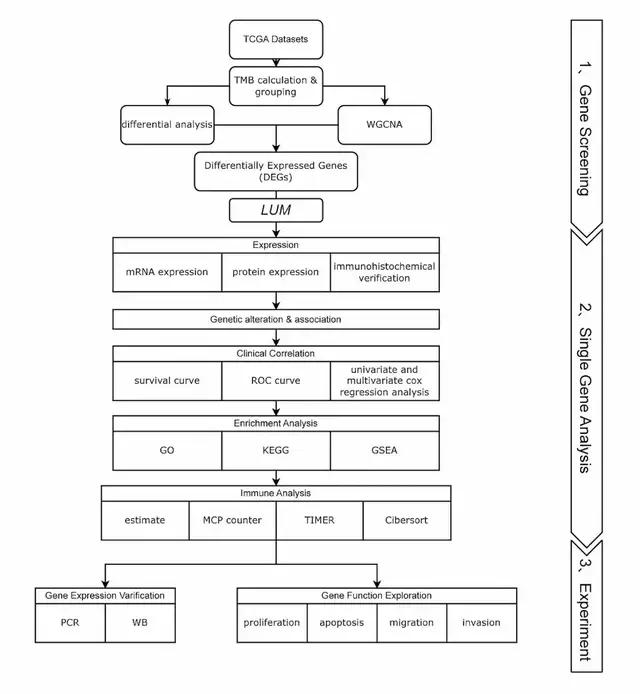
图1 本工作流程图,分为三个部分:(1)基因筛选、(2)单基因分析、(3)实验
研究结果
研究者从TCGA数据库中获取肝癌数据并计算TMB后,根据TMB中位数将样本分为两组;随后应用WGCNA构建基因共表达网络,将具有相似表达模式的基因导入同一模块,形成分层聚类树,其中每种颜色代表一个模块(图2a)。
其中,红色模块在高低TMB组之间的差异最为显著(r=0.18,p=0.00056)(图2b),对红色模块进行基因本体(GO)分析,发现基因主要富集于细胞外基质(ECM)组织和胶原结合通路(图2c)。京都基因与基因组百科全书(KEGG)分析显示,基因主要富集于局灶黏附、ECM受体相互作用和PI3K-Akt信号通路(图2d)。
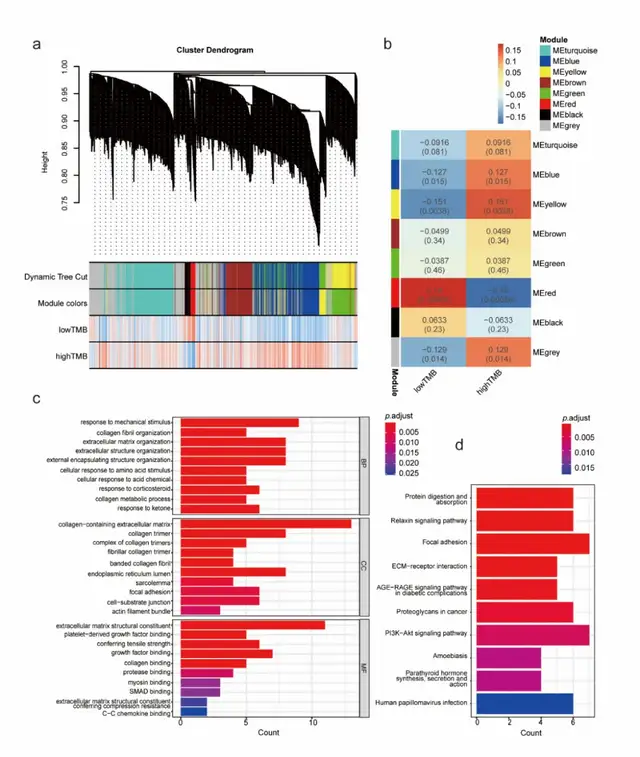
图2 a WGCNA模块示意图。动态树切分表示初始模块。模块颜色代表最终模块。等级树中的每个分支或每条垂直线代表一个基因。b WGCNA模块性状相关图。每行代表一个模块。每一列表示一个属性。蓝色表示负相关,红色表示正相关。c 红色WGCNA模块中的GO基因富集分析:生物过程(BP)、细胞成分(CC)和分子功能(MF)。d 红色WGCNA模块基因的KEGG富集分析
在差异分析中,该研究将低TMB组设为对照组,鉴定出了105个差异基因;随后使用Venn图确定了红色模块和DEGs之间重叠的枢纽基因,包括MYL9、AEBP1、CCL21和LUM(图3a),并最终选择LUM作为靶基因。
研究者分析了TCGA肝癌数据集样本的RNA-Seq谱,发现肿瘤组织中LUM的表达和蛋白水平均明显低于正常组织,性别和年龄差异不显著(图3b-e)。人类蛋白质图谱(HPA)和临床样本的免疫组化也证实了这一结果(图3f-h)。
研究者通过实时荧光定量PCR和Western blotting检测了4种肝癌细胞系(SNU398、SNU182、HepG2和Hep3B)和1种正常肝细胞系(LX-2)中LUM的表达。结果显示,所有癌细胞系的LUM表达水平均低于正常细胞系(图3i-k);与LX2相比,PCR中的Hep3B、Western blotting中的HepG2和Hep3B存在显著差异(图3i, k)。
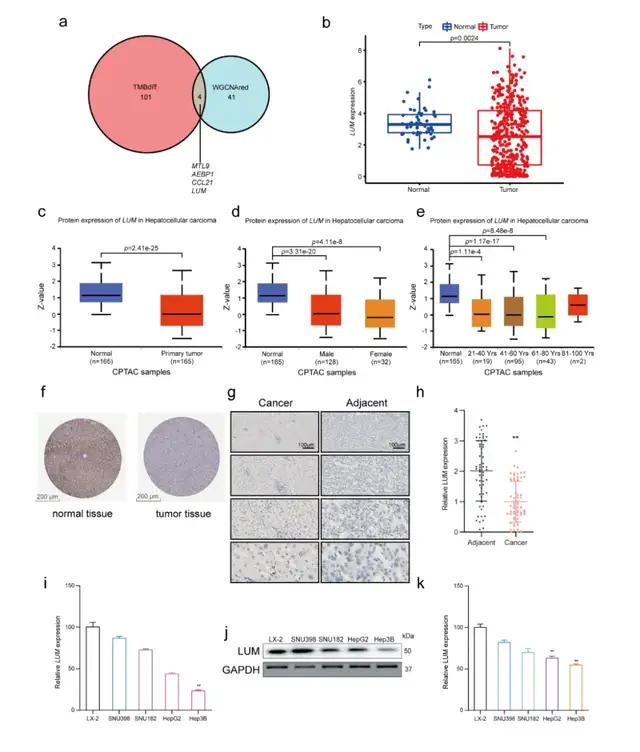
图3 a 来自WGCNA红色模块和DEGs的枢纽基因的Venn图。b 在LIHC和正常样本中LUM基因的表达水平。c 在LIHC和正常样品中LUM蛋白的表达水平。d-e LUM蛋白表达与临床特征的关系。f HPA数据库中正常组织和肝癌组织中LUM的免疫组化结果。g 临床HCC及邻近标本的免疫组化结果,从上至下分别以100倍、200倍、400倍和800倍的增量放大。h 临床HCC及邻近标本中LUM蛋白的相对表达水平。i PCR检测LX-2、SNU398、SNU182、HepG2和Hep3B细胞中LUM的表达水平。j-k WB检测LX-2、SNU398、SNU182、HepG2和Hep3B细胞中LUM蛋白的表达水平
LUM与患者生存和预后相关分析表明,与白人相比,亚洲人LUM的整体表达水平较低 (图4a),高LUM组亚洲患者的疾病特异性生存期DSS和无疾病间隔PFI两者预后较好(图4b)。此外,针对所有患者的诊断性ROC曲线显示出LUM潜在的预测能力(曲线下面积AUC=0.630,图4c)。随后,研究者通过最小p值法确定了LUM是HCC患者PFI的一个指标(截止值=0.8,p=0.028)(图4d)。单因素和多因素Cox回归分析进一步证实了这一点(图4e-f)。
该研究使用TIMER2.0软件对LUM与HCC相关基因TP53、KRAS、PTEN和CCND1进行相关性分析,发现表达趋势一致(图4g)。与野生型TP53或CTNNB1患者相比,突变TP53或CTNNB1患者的LUM表达较低(图4h)。LUM的表达与B细胞、中性粒细胞和骨髓树突状细胞的浸润水平呈正相关(图4i)。
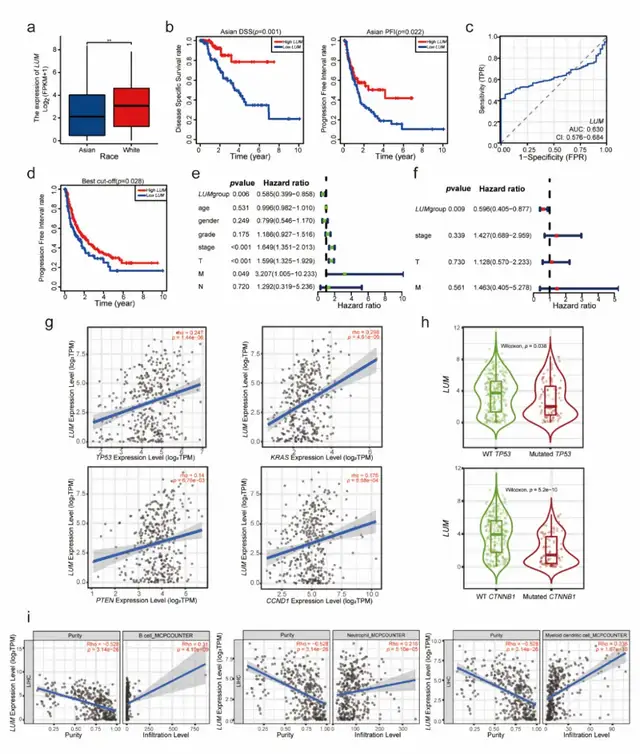
图4 a 亚洲人的LUM转录水平低于白人。bLUM高表达组的亚洲患者DSS和PFI预后较好。c 所有患者的诊断性ROC曲线。dLUM组LIHC患者PFI的K-M图,p值最小法(p=0.028)。e-f LIHC患者的单因素和多因素PFI分析。gLUM表达与TP53、KRAS、PTEN、CCND1表达呈正相关。hLUM在TP53或CTNNB1突变的患者中表达下调。i利用MCP-Counter对LUM与B细胞、中性粒细胞、髓树突状细胞免疫浸润水平的偏相关分析。
在GO分析中,高LUM组基因在ECM组织和胶原结合相关通路富集(图5a)。根据KEGG分析,这些基因主要属于PI3K-Akt信号通路、局灶黏附和ECM受体相互作用相关通路(图5b)。基因集富集分析显示,与细胞黏附和ECM相关的多个基因组,以及凋亡和肿瘤通路均在高LUM组中富集 (图5c-f)。
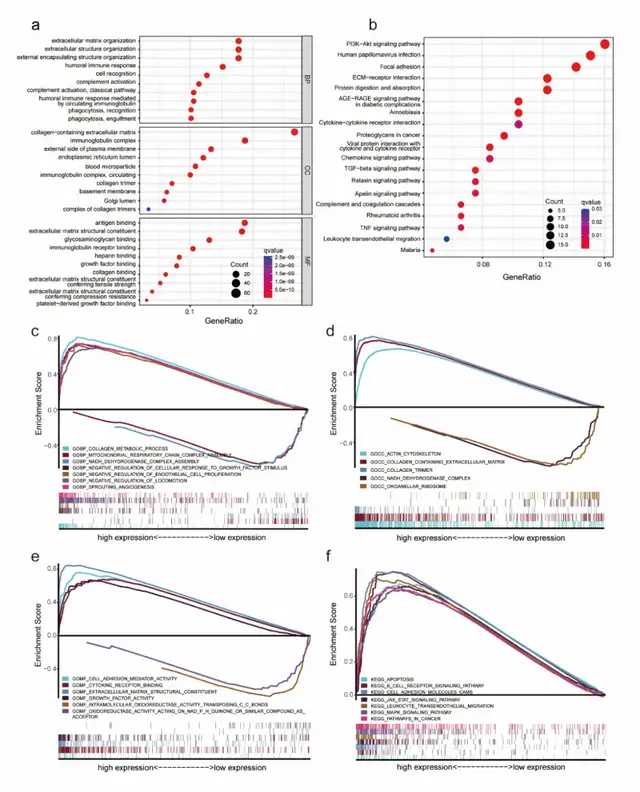
图5 aLUM组的GO富集分析。bLUM组的KEGG富集分析。c-f GSEA显示在低和高LUM组中富集的通路
为了进一步研究LUM的功能,该研究选择了两种肝癌细胞系SNU398和Hep3B,并通过载体在这些细胞中过表达LUM。PCR证实转染细胞中存在LUM,而Western blotting显示与对照组相比,LUM的表达增加(图6a-b);免疫荧光染色显示了LUM在细胞中的定位(图6c),这些转染的细胞被定义为LUM组。CCK-8实验显示,与正常SNU398和Hep3B细胞相比,LUM组的吸光度较低,细胞增殖减少(图6d-e),96小时后,转染LUM的细胞生长速度变慢(图6f)。

图6 a-b 在SNU398和Hep2B细胞中验证LUM过表达,包括PCR (a)和WB (b)。c 免疫荧光染色显示LUM在预期的细胞区室中定位。d-e 对照组和LUM过表达组在SNU398 (d)和Hep2B (e)中的吸光度和生长曲线。f 对照组和LUM过表达组在SNU398和Hep2B中96小时的细胞增殖照片
在平板克隆形成实验中,LUM组克隆的大小和数量受到抑制。细胞增殖染色中,LUM过表达组edu阳性细胞率降低,表明细胞增殖减少,LUM过表达抑制细胞增殖(图7),这些差异在两种癌细胞系中都是显著且一致的。
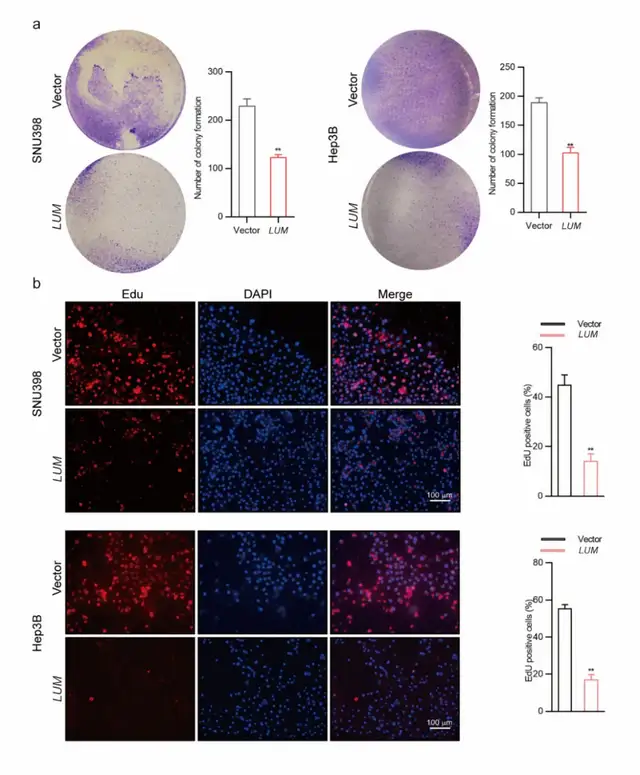
图7 a 在平板克隆形成实验中,LUM过表达组克隆的大小和数量受到抑制。bLUM过表达组edu阳性细胞数量减少
该研究采用Annexin V-FITC/PI染色法观察LUM过表达是否诱导凋亡。与对照组相比,转染LUM的SNU398细胞的凋亡率更高,早期凋亡(从~20.8%增加到~51.8%)和晚期凋亡(从~16.8%增加到~18.4%)均有所增加(图8a)。此外,在Hep3B细胞中观察到同样的趋势(早期凋亡从~0.57%增加到~29.0%,晚期凋亡从~0.57%增加到~7.58%,图8b),损伤后0和24小时对SNU398和Hep3B细胞的划痕实验图像如图8c-d所示。与未处理的细胞相比,过表达LUM的细胞迁移和伤口愈合减少。Transwell实验显示,过表达LUM可阻止SNU398和Hep2B细胞的迁移(图8e-f),还可减弱这些细胞的迁移活性(图8g-h)。因此,该文研究者认为LUM可以抑制肝癌细胞的迁移和侵袭。
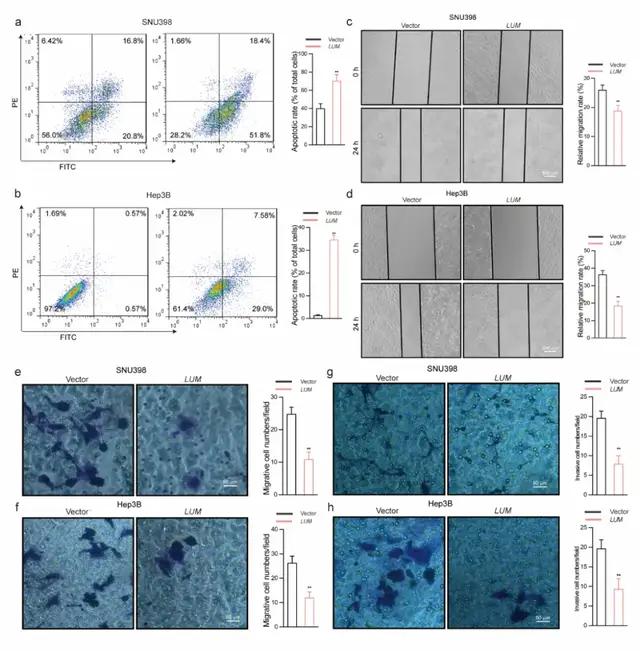
图8 a 膜联蛋白V-FITC/PI染色法(PE:藻红蛋白)。在转染LUM的SNU398细胞中,早期凋亡从~20.8%增加到~51.8%,晚期凋亡从~16.8%增加到~18.4%。b 在转染LUM的Hep2B细胞中,早期凋亡从~0.57%增加到~29.0%,晚期凋亡从~0.57%增加到~7.58%。c-d 划痕实验显示,LUM组对SNU398和Hep2B细胞的细胞迁移能力明显降低。e-h Transwell分析显示,两种HCC细胞系LUM组的迁移细胞数(e-f)和侵袭细胞数(g-h)均显著低于对照组
研究结论
该研究表明,LUM的表达与肝癌的发展有关:LUM在HCC中低表达;它是PFI的一个指标,与许多与HCC功能相关的重要基因有关。此外,LUM还具有免疫浸润作用;与LUM相关的丰富通路和实验验证共同支持其参与HCC的发病机制。总的来说,这些发现揭示了LUM作为一种新的生物标志物和预测预后和免疫反应的潜力。
Abstract
Hepatocellular carcinoma (HCC) is one of the most common cancers worldwide, and immune checkpoint inhibitor (ICI)-based therapies are now an integral part of systemic treatment. In this study, we identify potential biomarker for HCC and further investigate its functional significance using both bioinformatic and experimental methods. Differential analysis and weighted gene co-expression network analysis (WGCNA) were conducted, identifying Lumican (LUM) as the target gene. Our results showed a significant downregulation of LUM in HCC.LUMexpression was also associated with the progression-free interval and the infiltration of B cells, neutrophils, and myeloid dendritic cells. Enrichment analysis highlighted the involvement ofLUMin focal adhesion and the extracellular matrix. In addition, overexpression ofLUMsuppressed proliferation, migration and invasion in hepatoma cell lines while promoting cell apoptosis. Our results demonstrate the importance ofLUMin HCC development and may help to elucidate the underlying mechanisms and biological processes influenced byLUM.
