在医疗领域,科学家们一直在寻找能够有效促进细胞生长和修复的材料。
最近,磷酸钙(CaP)作为一种生物材料受到了广泛关注。
这种材料不仅无毒、具有良好生物相容性和生物降解性,还能与多种生物分子紧密结合,成为固定生物分子的理想载体。

今天,我们就来聊聊磷酸钙是如何成为这一领域的明星材料的。
商业纯钛盘(IV级,直径10毫米,厚度2毫米)被广泛用于医疗器械中。
为了提高其生物活性,研究人员采用了一种创新的方法:将钛盘表面涂覆磷酸钙,并负载一种名为VAP的生物分子。

具体来说,钛盘首先在丙酮、无水乙醇和蒸馏水中进行超声清洗15分钟,然后浸泡在140毫摩尔/升的氢氧化钠溶液中6小时,以活化表面。
接下来,活化的钛盘被浸入含有氯化钙的改性DPBS溶液中24小时,形成磷酸钙涂层。
为了进一步加载VAP,磷酸钙涂层的钛盘再浸泡在不同浓度的VAP溶液中24小时。

通过扫描电子显微镜观察发现,随着反应时间的增加,钛盘表面逐渐形成了白色涂层。
最初,3小时后可以看到稀疏的薄片结构晶体,随着反应时间延长至24小时,这些薄片结构变得越来越致密。
这种变化表明,磷酸钙涂层的形成与溶液中的离子相互作用密切相关。
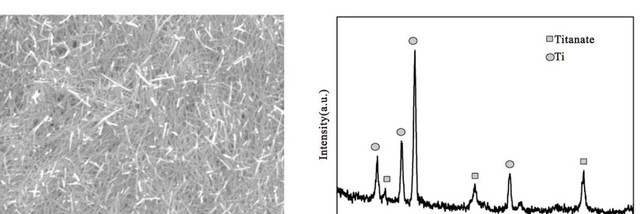
特别是,钛表面的阴离子如TiO4^4-、HTiO3^-和Ti3O7^2-与溶液中的钙离子结合,形成了稳定的磷酸钙晶体。
为了验证VAP是否成功加载到磷酸钙涂层中,研究人员使用了多种分析手段。
例如,通过能量色散光谱(EDS)和X射线光电子能谱(XPS),他们检测到了VAP中的氮元素。

此外,通过mBCA测定法,研究人员还定量测定了VAP的加载量。
结果显示,随着VAP初始浓度从200微克/毫升增加到800微克/毫升,共沉淀的VAP量也从15.19微克增加到142.64微克。
这表明,VAP确实成功加载到了磷酸钙涂层中。

接下来,研究人员研究了VAP在生物环境中的释放动力学。
他们将涂有CaP/VAP600的钛基板浸入PBS溶液中,观察了28天内的VAP释放情况。
结果表明,VAP的释放是缓慢而持续的。

即使在28天后,也只有约37.71%的VAP被释放到溶液中。
这一发现非常重要,因为它证明了磷酸钙涂层可以有效地控制VAP的释放速度,提供长期稳定的药物递送效果。
为了评估CaP/VAP涂层对细胞的影响,研究人员选择了施旺细胞RSC96作为实验对象。

这些细胞被广泛用于神经组织工程研究。
实验结果显示,与纯磷酸钙涂层相比,负载VAP的CaP涂层显著提高了RSC96细胞的粘附能力。
细胞骨架染色结果显示,附着在CaP/VAP涂层上的细胞扩散良好,形态正常。

此外,CCK-8检测也证实了这一点,表明CaP/VAP涂层能够为神经细胞提供一个有利于生长的环境。
为了进一步验证CaP/VAP涂层的安全性,研究人员进行了细胞毒性测试。
结果显示,负载VAP的CaP涂层对RSC96细胞没有明显的毒性作用,且在氧化应激损伤后仍能有效维持细胞活力和正常增殖。

这表明,CaP/VAP涂层不仅具有良好的生物相容性,还能在复杂的生理环境中保持稳定性能。
除了神经细胞,CaP/VAP涂层还在其他类型的细胞中表现出优异的性能。
例如,在心肌细胞中,CaP/VAP涂层能够减弱H2O2引起的氧化应激和凋亡,保护心脏功能。

此外,CaP/VAP涂层还能促进成骨细胞的增殖和分化,有助于骨骼修复。
这些研究表明,CaP/VAP涂层在功能性药物分子缓释、伤口愈合、组织工程和周围神经修复等领域具有广阔的应用前景。
总之,磷酸钙作为一种生物材料,凭借其无毒、良好的生物相容性和生物降解性,成为了固定生物分子的理想载体。

通过仿生矿化法,研究人员成功地将VAP加载到磷酸钙涂层中,实现了对VAP的长期稳定释放。
这一技术不仅为神经细胞提供了有利的生长环境,还在多个领域展现了巨大的应用潜力。
未来,随着研究的深入和技术的进步,磷酸钙及其复合材料有望为医学带来更多的突破和创新。

