*仅供医学专业人士阅读参考
点击右上方“关注”,准时接收每日精彩内容推送。
患有闭塞性动脉疾病(如冠心病和外周动脉疾病)的患者需要进行血管重建手术。血管再通的标准疗法是自体血管移植,即从身体的某个部位移除血管,然后植入受损部位。目前用于小直径血管(小于 6 毫米)的金标准自体移植物包括大隐静脉 (SV)、乳内动脉 (IMA) 和胸内动脉。此外,自体血管移植并不总是一种可行的调理方案,例如,由于质量差,有≈30% 的采集大隐静脉被认为是不可用的。目前,小口径组织工程血管移植物(TEVGs)临床转化的障碍在于体内植入后的长期通畅性。主要原因是移植物的机械性能不足和血流动力学条件不匹配导致血栓形成和血管狭窄。
来自荷兰乌得勒支大学的 Debby Gawlitta团队和来自德国维尔茨堡大学的Tomasz Jungst团队合作开发了一种机械可调的双层复合 TEVG 的方法。结合使用溶液电纺丝(SES)和熔融电写入(MEW),该方法可定制机械性能,并重现应力-应变关系的自然 J 形。细胞播种后,复合 SES 层的管腔表面可形成汇合的成熟内皮结构。MEW 纤维提供结构支撑,促进间充质干细胞以近似原生血管的方向堆积和定向。通过在 SES 过程中调整聚(ε-己内酯)和聚(酯-氨基甲酸乙酯)的比例,可以制造出具有一系列可调机械性能的 TEVG。值得注意的是,这种混合方法允许调节 TEVG 的径向拉伸特性,以接近不同的原生血管。总之,本研究开发了一种制造 TEVG 的策略,这种 TEVG 具有与原生血管相似的机械性能,有助于在未来的应用中适应 TEVG 在不同调理部位的长期通畅性。相关工作以题为“Hybrid Co-Spinning and Melt Electrowriting Approach Enables Fabrication of Heterotypic Tubular Scaffolds Resembling the Non-Linear Mechanical Properties of Human Blood Vessels”的文章发表在2024年01月28日的国际著名期刊《Advanced Functional Materials》。

1. 创新型研究内容
本研究选择了两种纤维几何形状。第一种几何形状被称为 "纤维偏移",在将纤维堆叠在一起以形成更大的孔隙区域之前,构造的前八层以 125 微米的恒定偏移量进行偏移。这种几何结构是许多 MEW 结构的基础。图 1A 和 B 分别展示了 MEW 几何结构和由此产生的细胞取向概览。之前的研究中也采用了 MEW 纤维的随机加固几何形状,它提供了结构队列,引导细胞朝 74 ± 27° 的角度定向,近似于原生小直径血管中 SMC 的生理定向(62.0°)。相比之下,仅具有较大 MEW 孔的 MEW 管的箱形几何结构导致细胞定向的变化最大;这表明细胞与 MEW 纤维的距离越远,所提供的定向线索就越弱。PEU 的 SES 纤维直径介于 1.1 ± 0.3 µm 和 PCL 的 1.6 ± 0.4 µm 之间。在进行量化时,对几种结构采用了 n = 50 的样本量。总体而言,纤维移位几何形状在制造和引导细胞定向方面具有最高的可重复性。

图1 不同 MEW 几何结构对 MSC 定向的影响
不同材料的混合也可通过改变每种材料的固有机械特性来改变构造物的机械特性,而本研究的目的是保持共纺绒毛的各自特性,以实现非线性应力-应变响应。此外,为确保生成的构造物具有可比性,本研究调整了纺丝时间,以挤出相同数量的材料,同时将挤出速度提高一倍,以实现更高的材料分布比。因此,通过 SES 制造出了 PCL 与 PEU 重量比(1:1、1:2 和 2:1)不同的共纺结构,并对其进行了表征(图 2A)。为了最大限度地降低 SES 绒毛上的 MEW 构建物分层的风险,在所有含有 PEU 的 SES 构建物的末端都纺上了一薄层纯 PCL。这样,这样就能确保纤维与 PEU 正确缠结,并提供足够的熔融来固定 MEW 结构。在所有条件下,双层支架都记录到了明显的 J 形轨迹(图 2B)。以前的研究表明,MEW 构建物可以通过调整纤维沉积来显示广泛的机械特性,并显示出特征性的 J 形应力-应变轨迹,这与血管的典型行为一致。这一轨迹在 1:2 比率,尤其是 1:1 比率中更为明显,20%应变后的应力起始点更为陡峭,两种 MEW 几何增强材料之间的总体峰值应力差异更大。相比之下,2:1 比率的应力总体增长较为平稳,没有 1:1 和 1:2 比率在 20% 应变左右出现的陡峭应力(图 2B)。此外,2:1 比例的 MEW 加固类型几乎没有差别。这一观察结果可归因于 PCL 含量较高,从而增加了比例的整体刚度,使变形需要更多的能量。此外,与其他配比相比,2:1 配比的 PCL 纤维含量更高,但构造壁厚度略薄,但并不明显(图 2C)。
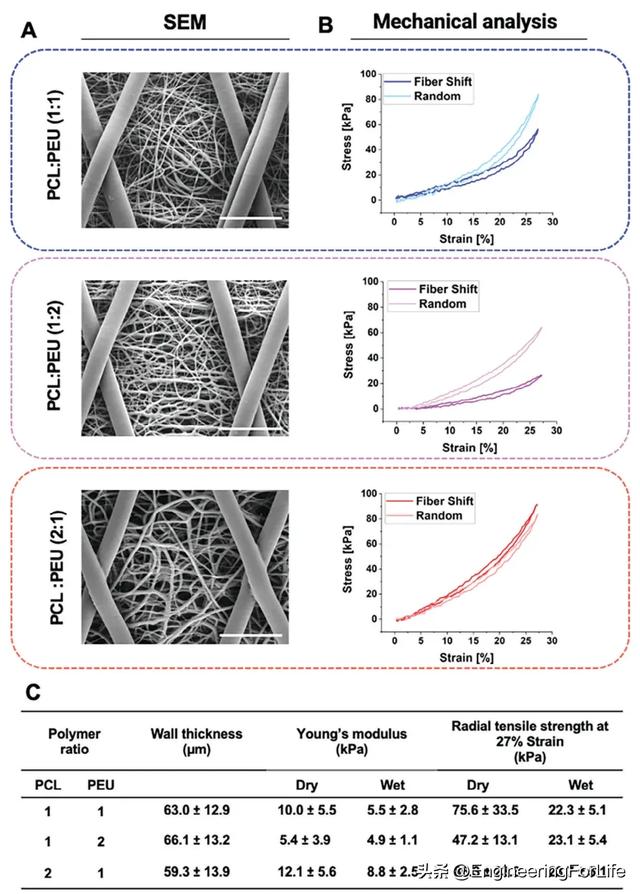
图2 PCL/PEU 聚合物比例对血管支架壁厚和机械性能的影响
本研究再次证明:MEW纤维提供的结构支撑促进了间充质干细胞以近乎环绕的方式紧密堆积和封闭,这反过来又触发了细胞表型的转变,即在没有分化生长因子(通常添加分化生长因子是为了触发向vSMC系的分化)的情况下,间充质干细胞在2周后向早期vSMC转变。细胞内收缩蛋白(α-SMA)的表达支持了这一表型变化,因为α-SMA的表达表明间充质干细胞早期向发育中的vSMC表型分化(图3B)。与 PEU 相比,1:2 和 2:1 比例中的α-SMA 染色强度中值更高,推断共纺 SES 构建物可改善间充质干细胞向 SMC 表型的分化(图 3C)。

图3 细胞播种聚合物组合的结构和生物学特征
为了保持可比性,本研究使用相同的测量装置直接比较了异型 TEVG 与原生人类血管的机械特性(图 4A)。为此,测量了常用于血管置换的人冠状动脉(CA)、隐静脉(SV)和 IMA。所有血管的内径相似,均为≈3 毫米(图 4B)。动脉血管(IMA 和 CA)和静脉血管(SV)的机械特性存在明显差异,其中静脉血管的总体应力水平更高(SV:57 kPa),J 形更明显,样本与样本之间的偏差更大。而动脉的应力响应较低(IMA:37 kPa;CA:38 kPa),并保持了明显的 J 形,偏差较小(图 4B)。

图4 固定细胞播种小直径血管构建物的力学评估与固定人体血管的比较
接下来,本研究进一步证明,间充质干细胞和血管内皮细胞以 1:2 的比例共存于特选的混合物上,可导致细胞粘附、内皮形成和细胞向成熟表型分化,从而促成功能性 TEVG 所需的稳态环境。在没有分化生长因子的情况下,间充质干细胞表达了 vSMC 特异性蛋白,并在 TEVG 的基底侧表面沉积了原生 ECM 蛋白。SMC的收缩蛋白表达可分为早期(α-SMA)、中期(钙蛋白)和晚期(平滑肌肌球蛋白重链;SM-MHC)成熟阶段。值得注意的是,在没有分化生长因子的情况下,SMC早期和中期成熟蛋白α-SMA和钙蛋白的表达在培养3周后就很明显(图5A,C)。SMC 样细胞中穿插着富含胶原纤维的 ECM 基质,这赋予了原生血管机械强度。基底侧表面的Ⅳ型胶原纤维(图 5B)呈近环状排列。
为了评估本研究设计的支架在体内应用的潜力,本研究将细胞播种构建物的性能与原生血管的性能进行了比较。图 5G 展示了共培养的 1:2 共纺构建体在医学应用支架常用的三个标志性参数(最大拉伸应力、最大爆破压力和缝合保持力)方面的性能。最大拉伸应力描述了支架保持受力的能力,通常通过拉至断裂实验来实现。共纺支架的拉伸应力值≈8 兆帕,且变化较小(图 5G、H)。这一测量值超过了径向测量的血管承受应力的能力(人股动脉 1-2 兆帕;IMA 4.3 兆帕;SV 1.8 兆帕)。

图5 在双层异型 1:2 PCL/PEU 支架上共培养间充质干细胞和 ECFCs
2. 总结与展望
本研究开发了一种制造策略,它允许生成具有可调机械特性的 TEVG。所介绍的制造异型细胞播种构建体的方法提供了一种环境,既能复制以径向拉伸方式测量的原生血管的机械特性,又能满足一般合成支架对爆破压力和极限拉伸应力的要求。在 SES 网状材料中加入不同比例的聚合物,可以产生一系列不同的机械特性,并支持汇合内皮的形成。加入 PEU 作为第二种聚合物后,可通过与 PCL 共同纺丝来调节力学特性,并对径向拉伸加载产生可调的力学响应,比传统的线性拉伸测试更接近血管顺应性。改进后的 MEW 纤维几何形状可引导细胞周向定向,促进向平滑肌表型分化。从力学角度看,处于湿润状态的共纺构建体降低了整体应力/应变值,使其更接近生理值,同时还能提供足够的阻力,以便在血管置换或旁路手术中使用缝合线进行缝合。与原生血管相比,共同纺丝和共同培养的支架显示出接近生理轨迹的应力/应变行为。与目前有关合成支架的文献相比,本研究提出的方法可以缩小小直径移植物在整体应力应变 J 型轨迹和测量值方面的差距。事实证明,这种结合两种电动流体力学过程的方法能够以定制和特定的方式逼近血管力学,未来可以利用这种方法进行潜在的融合,从而更好地适应特定管状结构的个性化需求。对长期流动-灌注培养以及植入的评估将进一步验证本研究的 TEVG,并证明它有能力作为一种有效的制造策略,在未来应用于小直径血管移植物替代品。
了解更多
关注“EngineeringForLife”,了解更多前沿科研资讯~

