(人民日报健康客户端记者 王艾冰)12月5日,山西纳安生物科技股份有限公司首个抗体偶联药物(ADC)产品T320,获批美国食品药品监督管理局(FDA)的新药临床试验许可。就在同一天,悦康药业宣布,其全资子公司杭州天龙药业有限公司的“YKYY026注射液”获得美国FDA的临床试验许可,适应症为拟预防带状疱疹。
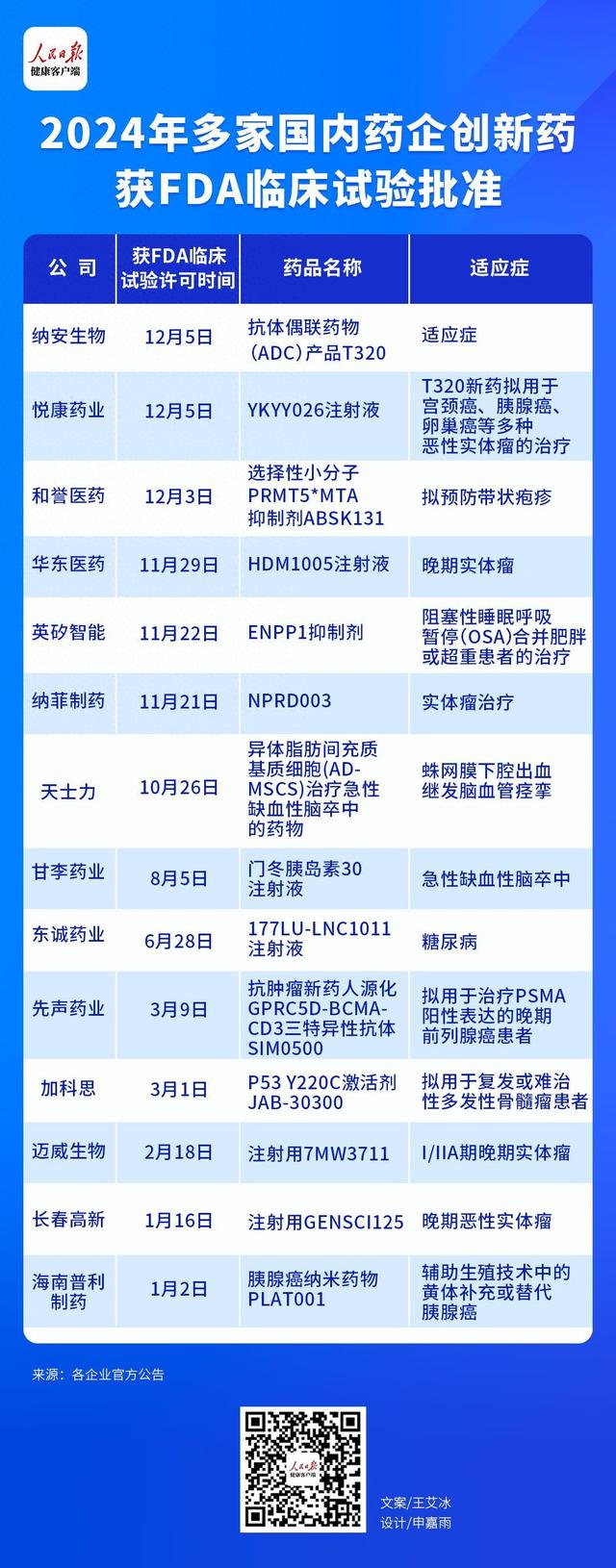
据人民日报健康客户端记者不完全梳理,2024年至今,已有超14款国内创新药获FDA临床试验批准,其中涉及预防带状疱疹的mRNA疫苗和治疗多种恶性实体瘤的ADC药物以及急性缺血性脑卒中用药等。
“近年,国内很多创新药公司都尝试在临床试验初期在国外同步申请临床试验,主要是有些药物在国外的临床试验速度可能会更快,可以给国内创新药企更多的信心的同时,国内对于创新药支付的一些限制也可以倒逼国内部分公司寻求国外临床试验且上市的机会。”12月9日,清华大学药学院创始院长、全球健康药物研发中心主任丁胜告诉人民日报健康客户端记者。
国投创新医药健康首席科学家、前CFDA药品评审中心首席科学家何如意也告诉记者,“国内药企在美国做临床试验同样也面临很多挑战,首先大多数国内药企没有专业团队,对国外的政策也不太了解,所以需要国外的合同研发组织(CRO)帮忙执行临床试验方案;另外,国外的病人较少,试验对象较为缺乏;同时,国外的研发成本也高于国内。”
“多款国内创新药获得FDA临床试验批准,体现了我国创新药发展的实力,也从侧面证实了我国药物创新水平符合在美国申报临床试验的资质。”丁胜强调,但是需要注意的是,一款药物从临床试验阶段到真正上市至少需要5-10年的时间,很多药物在临床试验阶段遭遇折戟也是较为常见的,所以任何一款药物从获批临床试验到真正上市,还有很长一段路要走。
