
码上下载
《人用药中亚硝胺杂质控制》指南中文版
亚硝胺原料药相关杂质(NDSRI)的推荐AI限值行业指南和建议实施时间表
2023年8月4日,FDA发布了关于亚硝胺原料药相关杂质(NDSRI)推荐可接受摄入量限度值的最终指南(2023年8月)(RAIL指南),该指南根据预测的致癌效力分类为NDSRI杂质的AI限值提供了建议。2024年9月4日,FDA发布了关于人用药物中亚硝胺杂质控制的最新指南(《人用药中亚硝胺杂质控制》第二版本)。亚硝胺指南描述了两类亚硝胺——小分子亚硝胺和NDSRI;还就控制亚硝胺的缓解策略和这些策略的实施向行业提供建议。制造商应参考这两项指南,了解有关确定AI限值的信息,以及有关减少或防止其药品中亚硝胺杂质的建议。
01基于预测的致癌效力分类方法(CPCA),用于具有形成NDSRI和其他已鉴定的亚硝胺杂质的假设风险的API。亚硝胺杂质可由胺(仲胺、叔胺或季胺)和亚硝酸盐(酸性条件下的亚硝酸盐)之间的亚硝化反应形成。亚硝胺杂质有两种一般结构类别:小分子亚硝胺杂质(与API结构不相似且存在于许多不同的药品中的亚硝胺杂质)和与API具有结构相似性且通常对每种API唯一的NDSRI。NDSRI可以通过对含有仲胺或二甲基叔胺中心的API和API片段进行亚硝化形成。这可能发生在与药品配方和制造工艺相关的条件下,例如与用于配制药品的辅料中的残留亚硝酸盐反应。
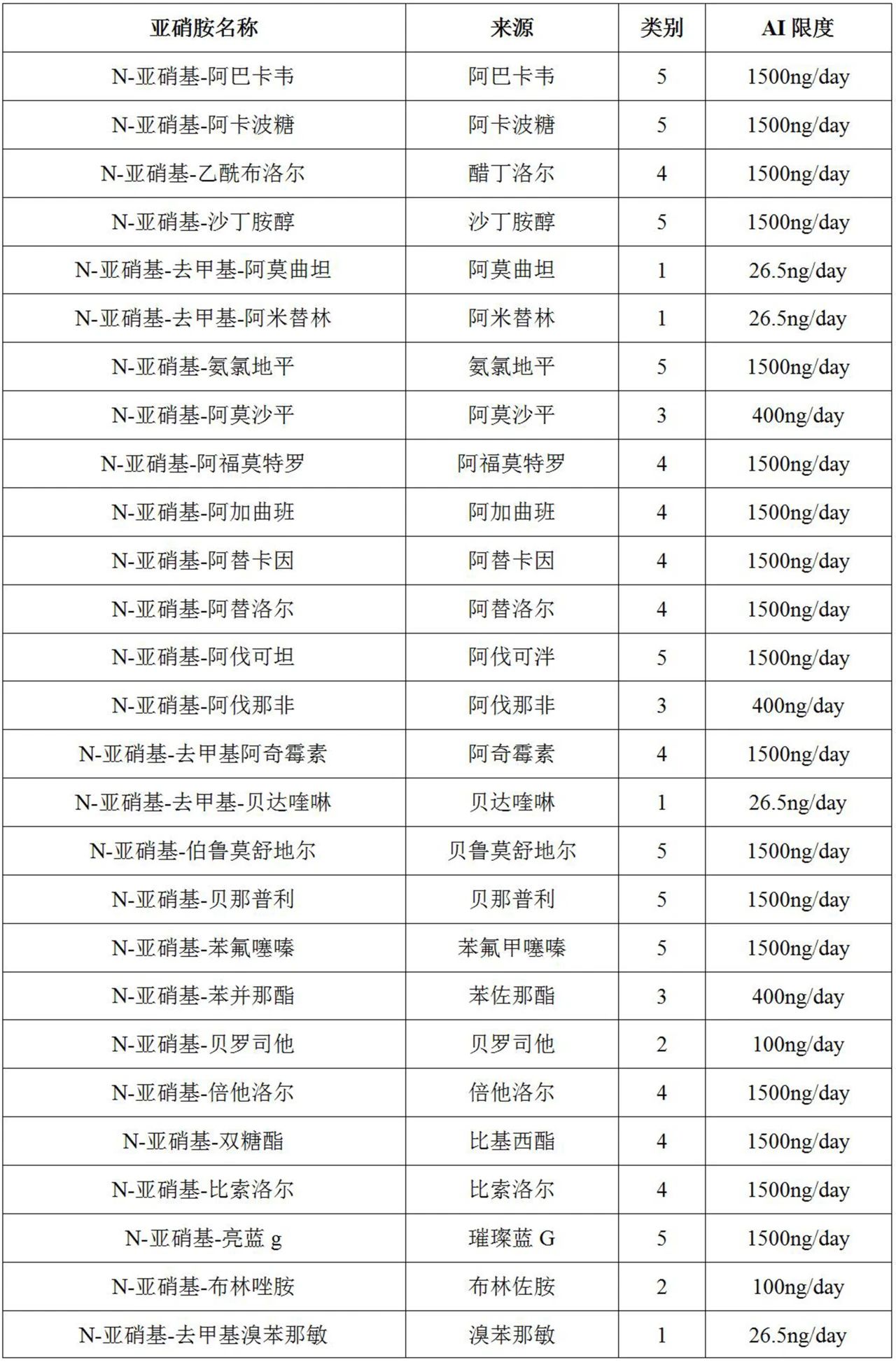
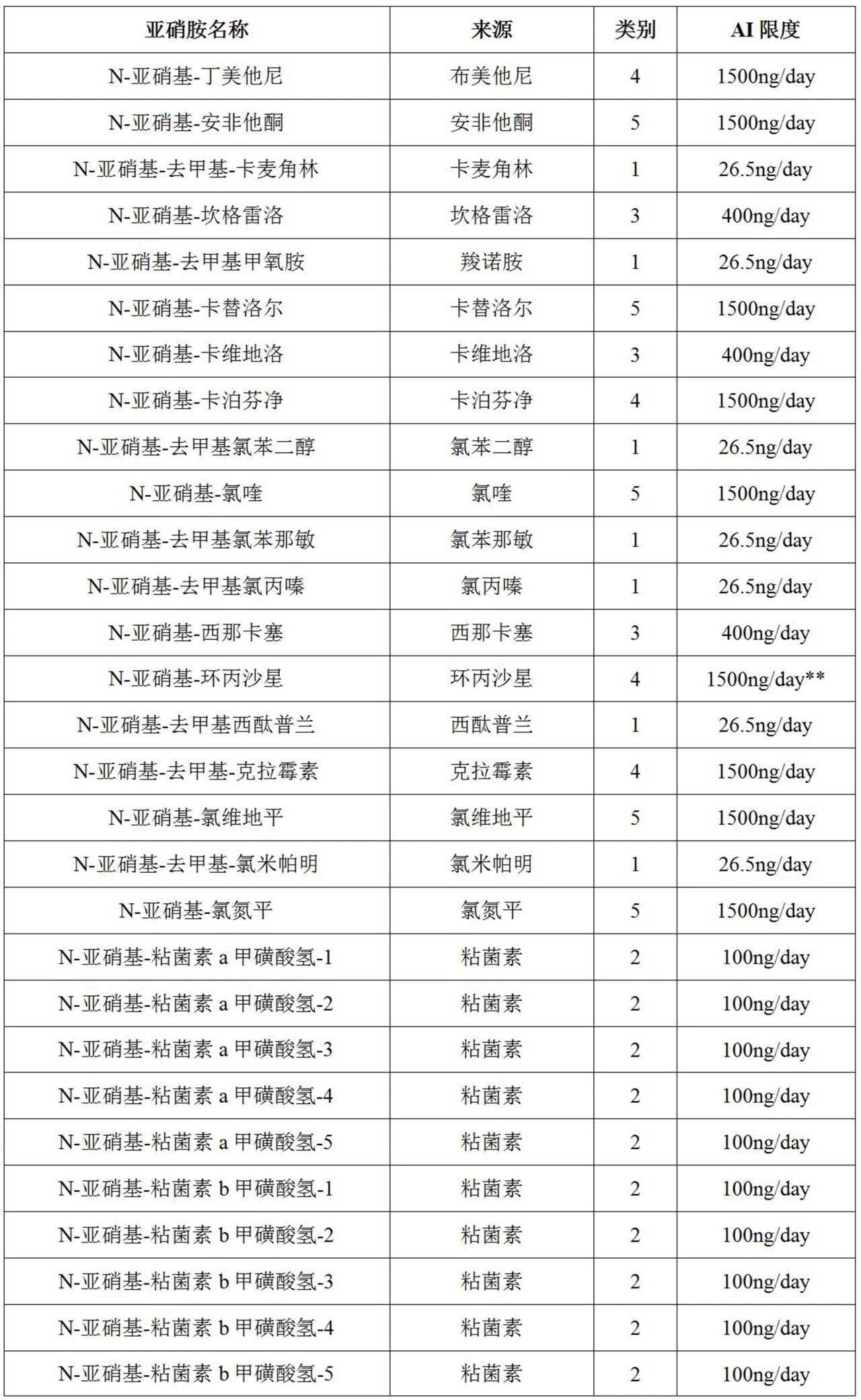
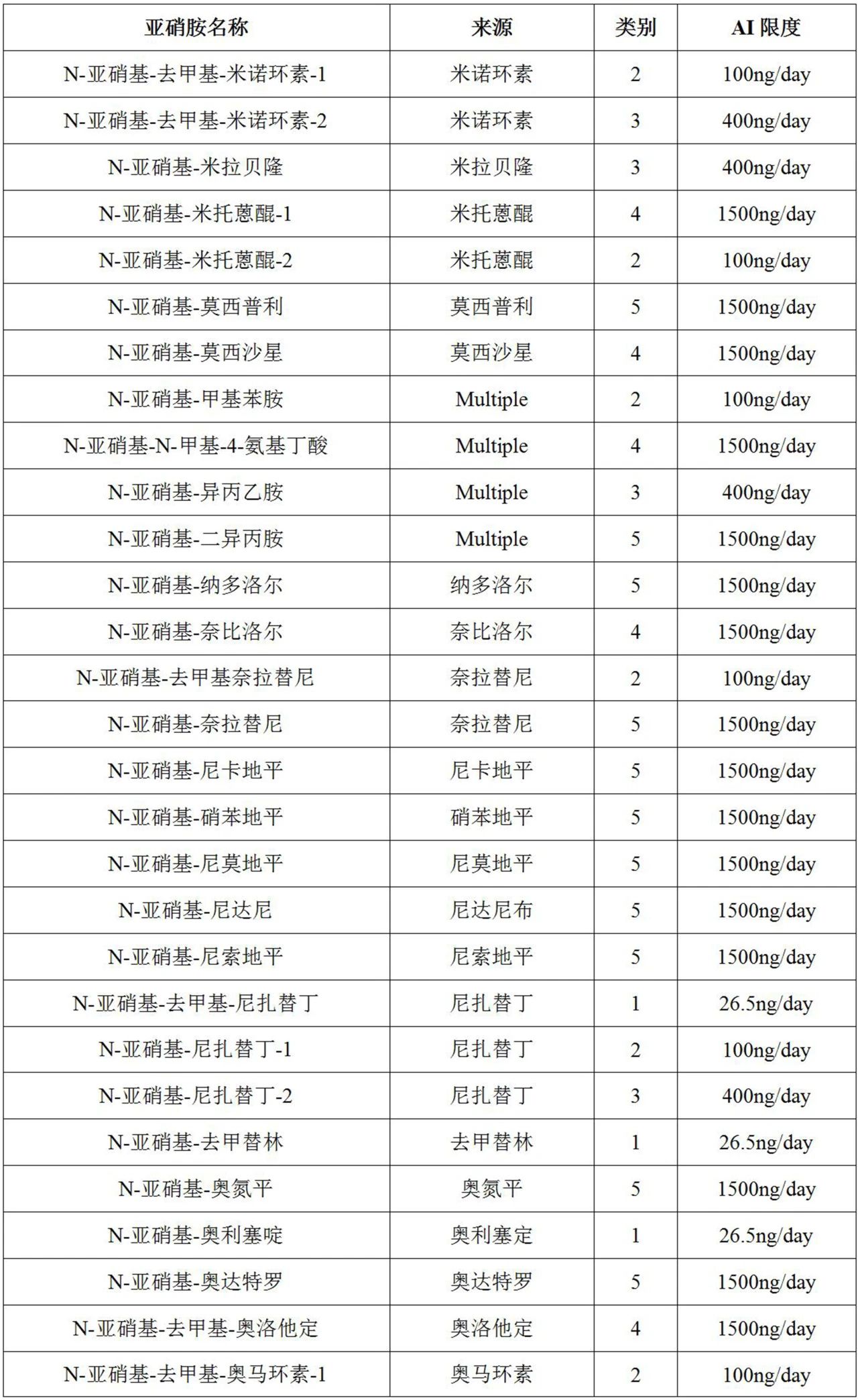
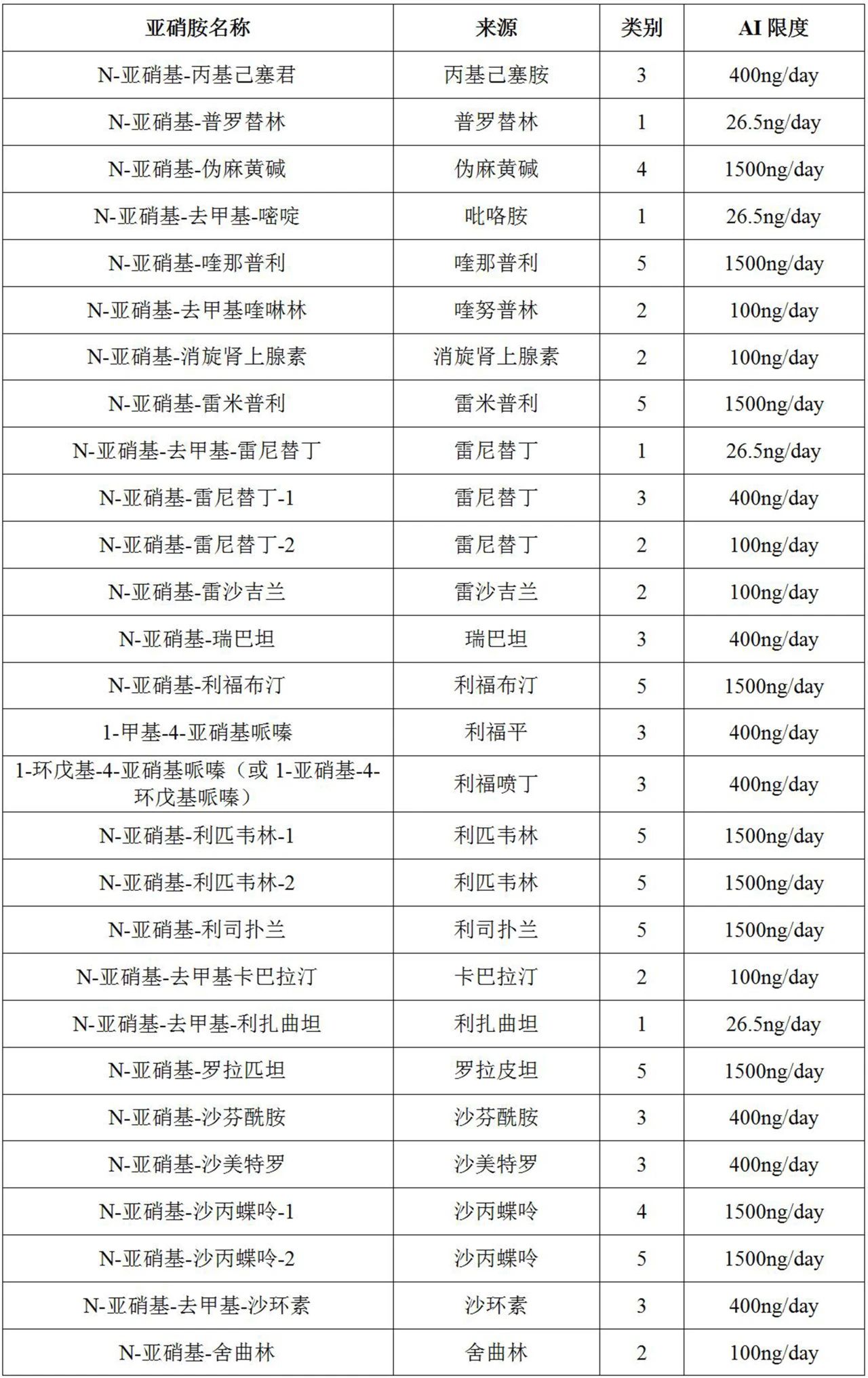
表1列出了200多种基于预测的致癌效力分类法(CPCA)的亚硝胺杂质(即NDSRI和其他已鉴定的亚硝胺杂质)的可接受摄入量(AI)限值,还列出了CPCA预测的其他已鉴定非NDSRI亚硝胺杂质的AI限值。
与特定API无关的另一个亚硝胺杂质的潜在来源是包装。如亚硝胺指南中所述,包装中的渗滤液可能是亚硝胺杂质或亚硝酸盐的来源,这些杂质或亚硝酸盐会反应形成亚硝胺杂质。
如果化合物特异性数据或替代物的交叉读取分析可用,并且更新后的推荐AI限值适用,FDA可能会将亚硝胺杂质移至表2。通常,如果FDA在表2中另行推荐了AI限值,则基于预测CPCA的推荐AI限值不应应用于亚硝胺杂质。
表1列出了由API单亚硝化形成的每种独特亚硝胺的预测致癌效力类别,其中来自同一API的每种亚硝胺在亚硝胺名称列中通过后缀“-1”、“-2”等进行区分。
表1FDA针对某些假设的NDSRI和其他已鉴定的亚硝胺杂质的推荐AI限值






02某些基于化合物特异性致癌性和致突变性数据分析的化合物推荐的AI限值
如果有数据,推荐的AI限值可以基于安全性评估,包括评估杂质的致突变性和致癌性潜力;该限值代表FDA确定杂质或杂质不会对患者构成安全问题的水平或低于该水平。可以根据已发表的科学文献中确定的啮齿动物致癌效力数据(例如TD50值)计算推荐的化合物特异性AI限值。当亚硝胺的致突变潜力没有得到充分表征时,FDA使用结构活性关系来支持鉴定在结构和反应性上与亚硝胺相似的经过稳健测试的替代物,以生成致癌效力的估计值,从中可以科学地确定AI限值。
表2列出了FDA根据化合物特异性数据或替代物的交叉读取分析对某些亚硝胺的AI限值。如果亚硝胺出现在表2中,则适用表2中推荐的AI限值,而不是表1中基于预测的致癌效力分类方法的限值。
表2FDA针对某些亚硝胺杂质的AI建议限值

03某些亚硝胺杂质推荐的临时AI限值如果已经上市的药品批次中的亚硝胺杂质含量高于FDA建议的AI限值,并且生产变更或召回可能导致药品供应中断,那么制造商和申请人应立即联系CDER的药品审评工作人员,联系方式drugshortages fda.hhs.gov。FDA会直接与已上市药物的特定制造商或申请人合作,并考虑是否适合推荐临时AI限制。如果FDA建议临时AI限值,则意味着不反对在某些情况下,在指定期限内销售亚硝胺杂质含量等于或低于建议的临时AI限值的此类药品批次,具体情况将根据具体情况确定。在某些情况下,如果FDA不打算反对从多个药品制造商销售的亚硝胺水平等于或低于建议的临时AI限值,FDA会发布此类建议的临时AI限值。
表3已批准或当前上市商品中某些亚硝胺杂质的推荐临时AI限值

04建议的实施时间表
FDA建议根据药品的监管状态和所讨论的亚硝胺杂质类型制定不同的实施时间表。在推荐实施时间表时,FDA可能会考虑对公共卫生的潜在风险、科学知识的状况、问题的范围、实施有效预防或缓解策略的可行性和复杂性以及药物短缺的风险等因素。例如,为了解决新的亚硝胺杂质,最有效的缓解措施可能是变更配方,这可能需要大量时间才能完成,因此FDA可能会建议更长的实施时间表。不同的亚硝胺杂质最好通过更换包装来解决,为此FDA可能会建议更短的实施时间。如果由于亚硝胺杂质构成重大公共卫生问题而迫切需要进行更改,则可能建议立即实施。在某些情况下,FDA在制定实施时间表时也可能考虑国际协调。
表4建议的实施时间表

