2023年美国心脏协会(AHA)发表科学声明首次提出心血管-肾脏-代谢综合征(CKM)概念,将心血管疾病、慢性肾脏病和糖尿病视为一个整体综合考量,提出更高的心肾综合保护要求。新型非甾体盐皮质激素受体拮抗剂(MRA)非奈利酮在不同CKM人群中已开展了三项III期临床研究:FINEARTS-HF、FIDELIO-DKD 和 FIGARO-DKD。鉴于不同CKM患者之间存在流行病学高度重叠,并拥有共同的临床结局驱动机制,研究者进行了一项预设的汇总分析——FINE-HEART研究,通过汇总三项III期研究的个体患者数据,在广泛CKM群体中深度探索非奈利酮对心血管、肾脏和死亡结局的影响。

当地时间2024年9月1日,在欧洲心脏病学会年会(ESC 2024)上,美国哈佛医学院Muthiah Vaduganathan教授团队公布了FINE-HEART研究数据,文章同期在线发表于《自然医学》(Nature Medicine)杂志[1]。总体结果表明,非奈利酮对包括心血管、肾脏和代谢疾病在内的广泛高危患者群体具有心肾益处,并可带来生存获益。本刊摘取重要结果,并特邀四川大学华西医院张庆教授进行深入解读。

一、研究背景:心血管-肾脏-代谢疾病相互关联,CKM概念强调共病共管、心肾同治
心血管疾病(CVD)、慢性肾脏病(CKD)和2型糖尿病(T2DM)是威胁人类健康的三大慢性疾病,这三者不仅在流行病学上表现出高度重叠性,且具有共同的病理生理学通路[2-4]。约半数糖尿病患者死于心血管疾病[5];CVD患者若同时合并T2DM和CKD,其心血管死亡风险升高7倍[6]。随着对疾病了解的不断深入,人们越来越认识到心血管系统、肾脏、代谢之间存在相互作用、相互影响的关系,若不及时加以综合管理,可能导致疾病恶性循环。
2023年美国心脏协会(AHA)发表主席建议,首次提出CKM新概念,将其定义为一种因肥胖、糖尿病、CKD和CVD之间病理生理相互作用导致的全身性疾病,包括存在代谢危险因素和/或CKD而具有CVD风险的患者;以及合并代谢危险因素或CKD的已患CVD患者[7]。CKM新理念强调共病共治,AHA科学声明建议以控制心肾风险进展为目标,进行综合管理[8]。
基于CKM疾病在发病机制及病理生理学存在重叠性,一种治疗策略或有可能同时改善多种共病的临床结局。FINE-HEART研究因此深度探索了非奈利酮在CKM人群治疗中的心血管、肾脏及代谢疾病的潜在益处。
研究设计及基线特征
非奈利酮已在两项针对T2DM合并CKD患者的III期研究中被证实可降低心血管事件和肾脏不良结局风险(FIDELIO-DKD 和 FIGARO-DKD)[9,10],近期又在一项针对左心室射血分数(LVEF)≥40%心衰患者的III期研究中被证明可降低心血管死亡和心衰住院风险(FINEARTS-HF)[11]。这三项研究均为全球、多中心、双盲、安慰剂对照、随机的III期临床试验,然而单独一项研究尚不足以评估非奈利酮对心血管死亡及全因死亡结局的影响,也缺乏多种CKM交叉疾病等关键亚组人群的数据。FINE-HEART研究通过将这三项研究的患者数据进行汇总分析,进一步扩大样本规模、丰富疾病种类,从而提高非奈利酮对重要心肾结局影响的评估准确性,并可获得共病负担较重的CKM人群结果[1]。

该分析纳入FIDELIO-DKD、FIGARO-DKD和FINEARTS-HF三项研究共18,991例患者数据,平均年龄67岁,35%为女性。平均估计肾小球滤过率(eGFR)为59 ml/(min·1.73m2),平均尿白蛋白肌酐比值(UACR)接近300 mg/g。81%患有糖尿病,84%患有CKD,37%患有心衰,约90%合并至少2种CKM疾病(T2DM、CKD或心衰),其中12%同时合并以上三种疾病(图1)。基线时,93%患者使用ACEI/ARB,8.9%患者使用SGLT2i,5.8%患者使用GLP-1RA[1]。

图1. FINE-HEART研究的基线CKM状态:共病负担较重
主要终点为心血管死亡。由于纳入的三项研究之间对心血管死亡的定义略有不同,FINE-HEART将其统一为心血管死亡(不包括不明原因死亡)。研究还对心血管死亡(不包括不明原因死亡)的主要终点进行了预设敏感性分析:将所有原因未明的死亡都视为CV死亡,以全面评估非奈利酮对主要终点的影响。
次要终点包括复合肾脏结局【定义为eGFR较基线持续下降≥50%,eGFR持续下降至<15 ml/(min·1.73m2),肾衰竭和肾脏原因导致的死亡】、心衰住院、心血管死亡或心衰住院复合结局和全因死亡等。
FINE-HEART研究中位随访时间为2.9年。
主要终点
心血管死亡(不包括不明原因死亡):非奈利酮组为4.4%,安慰剂组为5.0%(危险比[HR] 0.89;95% CI:0.78~1.01;P=0.076,图2左),非奈利酮组心血管死亡在数值上较低。
在对主要终点的预设敏感性分析中(包括不明原因死亡),非奈利酮组相对风险显著降低12%(6.6% vs. 7.4%;HR 0.88,95% CI:0.79~0.98;P=0.025,图2右)。
亚组结果广泛一致:在预设16个亚组分析中,非奈利酮对心血管死亡的影响基本一致。对于不同eGFR水平(P交互作用=0.32)和UACR(P交互作用=0.55)的患者,非奈利酮对心血管死亡的影响均一致。无论CKM共病负担如何,以及是否合并使用SGLT2i或GLP-1RA,主要终点结果均一致。
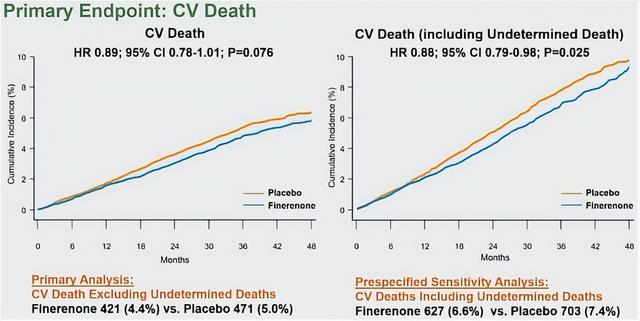
图2. FINE-HEART研究主要终点:心血管死亡
次要终点:
全因死亡:与安慰剂组相比,非奈利酮组全因死亡率显著降低9%(HR 0.91,95% CI:0.84~0.99;P=0.027,图3A)。
肾脏复合终点:与安慰剂组相比,非奈利酮组肾脏复合终点风险显著降低20%(HR 0.80,95% CI:0.72~0.90;P<0.001,图3B)。
心衰住院:与安慰剂组相比,非奈利酮组心衰住院风险显著降低17%(HR 0.83,95% CI:0.75~0.92;P<0.001,图3C)。
其他终点:非奈利酮还可显著降低心血管死亡或心衰住院风险15%(P<0.001),显著降低主要不良心血管事件风险9%(P=0.01),显著降低新发房颤风险17%(P=0.018)。
图3. FINE-HEART研究次要终点
疗效终点汇总
从疗效终点汇总来看,非奈利酮在多个心血管和肾脏预设疗效终点上均表现出优于安慰剂的疗效(图4)。

图4. 疗效终点汇总
安全性结果
与安慰剂相比,非奈利酮组发生严重不良事件的比例较低(34.6% vs. 36.6%)。高钾血症有所增加,而低钾血症有所减少。因高钾血症导致永久停药(1.3% vs. 0.5%)和高钾血症相关住院(0.8% vs. 0.2%)的发生率较高。未发生与高钾血症相关的死亡病例,各组之间急性肾损伤的发生率无差异(图5)。

图5. 安全性终点
FINE-HEART研究总体结果表明,非奈利酮可为广泛CKM患者群体带来多重获益,包括降低心血管事件和肾脏不良结局风险及全因死亡,且安全性和耐受性良好。该结果支持:非奈利酮对包括心血管、肾脏和代谢疾病在内的广泛高危患者具有延缓疾病进展的治疗潜力。
机制溯源:CKM共病管理应解决心肾疾病病理生理学的根本驱动因素
关于CKM的主要发生机制,AHA科学声明指出,CKM病理生理机制反映了代谢危险因素、CKD和心血管系统之间相互影响的多维度关系。炎症、氧化应激、胰岛素抵抗和血管内皮功能障碍是导致代谢危险因素发展、肾脏疾病进展、增强心肾相互作用以及心血管疾病发展的核心机制。其中,炎症纤维化作为心肾疾病的关键机制,在心血管系统会促进动脉硬化进展、心肌损伤,以及心室重构等,在肾脏则导致肾小球硬化、肾小管炎症和肾纤维化[8]。因此,心肾共治应从病理生理机制出发,解决CKM的根本驱动因素。
新型非甾体MRA:非奈利酮抗炎抗纤维化,直击心肾疾病关键驱动因素
盐皮质激素受体(MR)分布于肾、心多种组织细胞,MR过度活化引发的炎症纤维化是心肾疾病进展的关键驱动因素[12-14]。动物研究显示,MR敲除可有效改善心肾炎症和纤维化病变。直接拮抗MR过度活化成为延缓心肾疾病进展的重要靶点。非奈利酮是新型非甾体类MRA,具有独特的分子结构、理化特性以及药理学特点,对MR选择性更高、拮抗效力更强、性激素相关等不良反应更少,可直接阻断MR过度活化,进而阻断炎症及纤维化,针对心肾疾病病理生理性的关键驱动因素,延缓肾心疾病进展,从而为CKM患者带来进一步心肾获益(图6)[15]。

图6. 非奈利酮直接阻断MR过度活化,直击心肾疾病关键驱动因素
非奈利酮是首个获批用于改善T2DM合并CKD患者心肾结局的MRA。2024 ADA《糖尿病诊疗标准》、2023 ESC《糖尿病患者心血管疾病管理指南》和2023 ESC《急性和慢性心力衰竭诊断和治疗指南》等多个国际权威指南一致A级别推荐,非奈利酮用于T2DM合并CKD患者,以降低心血管及肾脏风险[16-18]。
目前,仍有多项关于非奈利酮在心肾领域的临床研究正在开展。在心衰领域,REDEFINE-HF研究、CONFIRMATION-HF研究和FINALITY-HF研究将在更广泛心衰患者中评估非奈利酮的疗效和安全性。在肾病领域,FIND-CKD研究旨在评估非奈利酮在非糖尿病CKD患者中的疗效和安全性。FINE-ONE研究将探索非奈利酮用于1型糖尿病合并CKD患者的疗效和安全性。此外,FINE-REAL研究将为非奈利酮在常规临床实践中治疗糖尿病相关CKD提供真实世界证据。
综上,MR过度活化介导的炎症纤维化是心肾疾病发生发展的关键驱动因素,新型MRA非奈利酮在CKM综合管理、心肾共治中展现出的巨大潜力令人振奋,期待其在临床治疗中发挥重要作用,使更多心肾疾病人群获益!
专家简介

张庆 教授
四川大学华西医院心内科教授、博士生导师、副主任
四川省学术技术带头人
四川省卫健委学术技术带头人
中华医学会心血管病专委会心力衰竭学组委员
中国医师协会心力衰竭专委会常务委员
中国医师协会心血管病专委会心力衰竭学组委员
四川省医学会心血管病专委会常务委员
2.Aggarwal R, et al. JAMA. 2024;331(21):1858-1860.
3.Ostrominski JW, et al. JAMA Cardiol. 2023;8(11):1050-1060.
4.Ostrominski JW, et al. J Am Coll Cardiol. 2024;84(2):223-228.
6.Holzmann MJ, et al.Eur J Prev Cardiol. 2016 Jul;23(11):1187-1194.
7.Ndumele CE, et al. Circulation. 2023; 148(20): 1636-1664.
8.Ndumele CE,et al. Circulation.2023;148 (20): 1606-1635.
9.Bakris GL, et al. N Engl J Med. 2020;383(23):2219-2229.
10.Pitt B, et al. N Engl J Med. 2021;385(24):2252-2263.
12.Kolkhof P,et al. Pharmacol Res. 2021 Oct;172:105859.?
13.Bauersachs J, et al. Br J Pharmacol. 2021 Oct 13.
14.Barrera-Chimal J, et al. Kidney Int. 2019 Aug;96(2): 302-319.
16.ADA. Diabetes Care. 2024;47(Suppl 1):S219-S230.
17.Marx N, et al. Eur Heart J. 2023;44(39):4043-4140.
18.McDonagh TA, et al. Eur Heart J.2023;44(37):3627-3639.
(来源:《国际循环》编辑部)
