研究癌症的科学家很早就发现,高达60%的成年白血病病例,以及其他一些类型的癌症,与一个叫TET2的基因有关。除了癌症,TET2突变还被发现会增加心脏病、卒中、糖尿病和其他炎症性疾病的风险。然而,为什么TET2基因或其相关基因发生突变会导致这么多问题,却是未解之谜。
日前,由美国芝加哥大学何川教授与得克萨斯大学圣安东尼奥健康科学中心徐明江教授领衔的研究团队在《自然》杂志发表论文,揭开了TET2突变的致癌之谜,他们的发现也为多种疾病的治疗提供了靶点。

何川教授是RNA表观遗传学领域的先驱,在过去的十多年里,他开创性地发现细胞的基因表达不仅受DNA修饰和蛋白质修饰的调控,也会被RNA上的可逆性修饰(如RNA甲基化)所调控。迄今为止,RNA上发现的修饰已经超过170种,如m5C、m6C、m7G等,这些RNA修饰在癌症等多种疾病中发挥重要作用。
在此次研究中,何川教授带领的团队发现,TET2发生缺陷时实际上影响的也是RNA的甲基化修饰,而不像TET家族过去被发现的的经典功能那样作用于DNA甲基化。
通过一系列基因编辑和分析技术,研究团队发现,TET2编码的TET 甲基胞嘧啶双加氧酶调节染色质相关的逆转录转座子RNA(简称caRNA)发生m5C甲基化的频率,进而影响染色质的开放状态。具体来说,当逆转录转座子RNA的m5C甲基化得以保留时,它们可以被甲基CpG结合结构域蛋白MBD6识别,从而招募去泛素化复合物,提高染色质的开放度。这在生命早期非常重要,因为此时干细胞需要积极分化为各种类型的细胞,染色质处于较为开放的状态有利于基因表达。
而到了成年阶段,TET2通过氧化caRNA的m5C来维持染色质的致密性,但是TET2缺失时,相当于放松了本该拉紧的缰绳,使染色质进一步开放,增加干细胞内的转录,重新打开生长途径——失控的生长最终可能导致癌症。
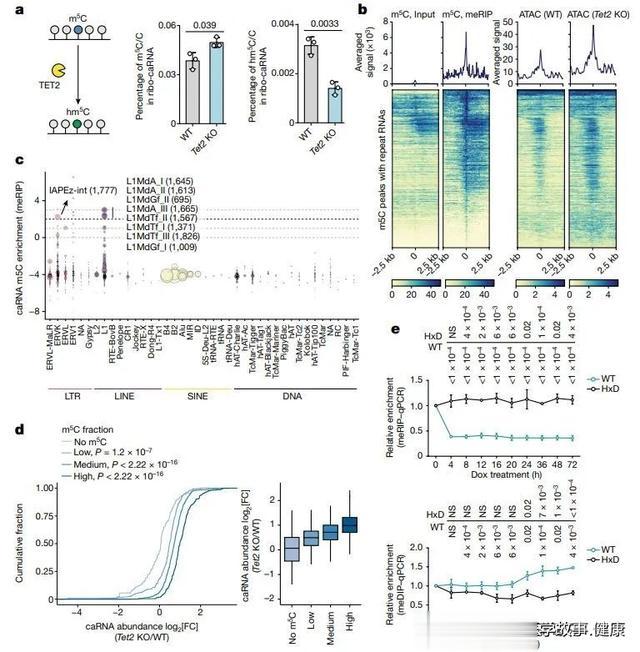
▲TET2缺失导致caRNA m5C甲基化升高,局部染色质开放(图片来源:参考资料[1])
实验结果显示,TET2突变型白血病就是因为造血干细胞内出现了异常的基因激活。当研究人员在TET2缺失的白血病细胞系中敲除了MBD6,重新加强对染色质可及性状态的控制,发现可以抑制癌细胞的生长。在小鼠模型中,敲低MDB6可以很大程度上逆转Tet2缺失引起的造血缺陷。
作者指出,这一令人振奋的结果表明了TET2下游的MBD6有望作为新的靶点,开发针对TET2突变的抗癌药物。不仅如此,有些患者具有TET2突变的血细胞,虽然还没有导致癌症,但具有炎性的突变细胞会随着血液循环影响心脏、肝等重要器官,因此根据这项研究的发现,也有可能通过消除这些突变细胞来预防相关疾病。
参考资料:
[1] Zhongyu Zou et al., (2024) RNA m5C oxidation by TET2 regulates chromatin state and leukaemogenesis. Nature Doi: https://doi.org/10.1038/s41586-024-07969-x
