肺癌是第一大肿瘤杀手,肺癌脑转移(LCBM)患者预后更差。目前以奥希替尼为代表的第三代酪氨酸激酶抑制剂(TKI)在靶向治疗EGFR突变的肺癌脑转移中呈现出良好的效果,但是靶向治疗后出现的耐药问题严重困扰着临床医生和患者。囿于肺癌脑转移标本获取困难、模型难建等问题,TKI如何影响肺癌脑转移的免疫微环境目前尚不清楚。因此,为了深入理解TKI治疗前后肺癌脑转移免疫微环境的动态变化,克服免疫逃逸,华山医院神经外科毛颖教授团队立足临床问题,将临床和基础研究紧密结合,利用国家神经疾病中心的优势,对此问题展开了研究。
2024年10月17日,复旦大学附属华山医院毛颖教授、花玮教授、迟喻丹研究员团队在Cancer Cell期刊(影响因子48.8分)在线发表了题为“Overcoming tyrosine kinase inhibitor resistance in lung cancer brain metastasis with CTLA4 blockade”的研究论文。该研究对肺癌脑转移样本进行单细胞测序,结果发现酪氨酸激酶抑制剂(如奥希替尼)能重塑肺癌脑转移的免疫微环境,在增加T细胞浸润的同时会上调免疫检查点CTLA4的表达,导致免疫逃逸;进一步在肺癌脑转移动物模型中,证实TKI和CTLA4单抗联合用药能有效激活T细胞,克服TKI后的免疫逃逸,为临床治疗肺癌脑转移提供了新思路。


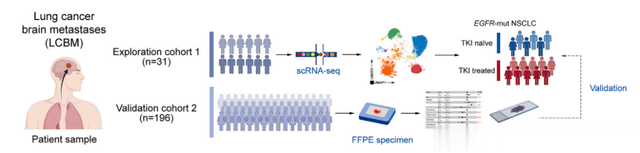
该研究收集了31例涵盖不同基因突变和靶向治疗的新鲜肺癌脑转移肿瘤样本,用单细胞测序技术描绘了其免疫微环境图谱,结果发现肺癌脑转移中的T细胞浸润程度要高于原发脑胶质瘤等,与肺癌原发灶类似。进一步分析发现,EGFR突变的肺癌脑转移中T细胞浸润相对匮乏。有趣的是,在接受过TKI治疗的样本中,T细胞浸润显著提高;但是在这些浸润的T细胞中,负性的免疫检查点CTLA4表达也随之升高,提示靶向治疗虽然改善了T细胞匮乏的状态,但浸润的T细胞并不能发挥相应的功能。这一发现也在196例的临床样本中得到了验证。
在机制上,该研究发现TKI会刺激肿瘤细胞释放HMGB1和CALR等免疫分子,进而刺激Toll样受体激活巨噬细胞、招募T细胞,从而导致TKI治疗后T细胞浸润增加。同时,肿瘤中浸润的T细胞也会通过Toll样受体识别HMGB1等,进一步激活了NF-κB信号通路,其中的p65转录因子可以与CTLA4结合,促进其表达上调。

该研究还构建了EGFR突变的肺癌脑转移小鼠模型,模拟临床上EGFR突变的肺癌脑转移。在动物模型中,TKI和CTLA4单抗的联合疗法能显著延长荷瘤小鼠的生存时间,进一步的单细胞测序证实联合治疗能增加效应T细胞的比例,这意味着T细胞杀伤肿瘤的功能的确得到了增强,克服了免疫逃逸,实现了免疫重振。荷瘤小鼠的肝、肺并未观察到病理损伤表现,各项生化指标均正常,提示该联合治疗方法安全。


综上,该研究详细刻画了靶向治疗前后肺癌脑转移免疫微环境的变化,揭示了TKI通过CTLA4上调来重塑负性免疫微环境的机制,并在动物模型中实现了免疫重振,为临床治疗靶向耐药的肺癌脑转移患者提供了新的思路。

复旦大学附属华山医院神经外科毛颖/花玮教授、迟喻丹研究员为该论文的共同通讯作者。复旦大学附属华山医院神经外科傅敏杰博士、复旦大学脑转院赵加旭博士后为共同第一作者。
Fu et al., Overcoming tyrosine kinase inhibitor resistance in lung cancer brain metastasis with CTLA4 blockade, Cancer Cell (2024), https://doi.org/10.1016/j.ccell.2024.09.012
